
下列大小比较正确的是
A.离子半径:Na+>Mg2+>Al3+>Cl— ;原子半径:Na>Mg>Al>Cl
B.稳定性:HF>H2O>NH3>CH4 ; 还原性: HF < H2O < NH3< CH4
C.碱性:CsOH>KOH>Mg(OH)2>NaOH ; 金属性:Cs>K>Mg>Na
D.酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C
科目:高中化学 来源:2013-2014江西省南昌市高一文理分科测试化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省九江七校下学期期中联考高二化学试卷(解析版) 题型:选择题
某有机物M是农药生产中的一种中间体,其结构简式如下,下列叙述正确的是( )
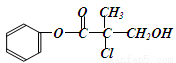
A.有机物M属于芳香烃
B.有机物M和浓硫酸混合加热,可以发生消去反应
C.有机物M 可以与Br2的CCl4溶液发生加成反应
D.1molM和足量的NaOH溶液反应,最多可以消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高一下学期期末考试化学试卷(解析版) 题型:填空题
元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
① |
|
| ||||||
|
|
|
| ② | ③ | ④ |
|
|
⑤ |
| ⑥ | ⑦ |
|
|
|
| |
(1)元素⑦在元素周期表的位置为______________,
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为 。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式__________________________________。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为_____________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:
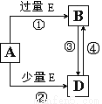
①E的电子式为 。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高一下学期期末考试化学试卷(解析版) 题型:选择题
已知A、B、C、D均是气体,反应A+B  C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是
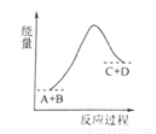
A.当A的正反应速率与C的逆反应速率相同时处于平衡状态
B.当A、B、C、D的浓度相同时,反应处于平衡状态
C.反应物的总键能量低于生成物的总键能
D.该反应是放热反应
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高二下学期期末考试化学试卷(解析版) 题型:实验题
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。2分
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。2分
③ 某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,有利于提高SO2的吸收效率。2分

(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式_________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是 (填字母)。



A B C D E
④ 滴定结果如下表所示:
滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 2.20 | 20.20 |
则该药品中Na2SO3的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高二下学期期末考试化学试卷(解析版) 题型:选择题
美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁?沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享诺贝尔化学奖。经研究发现GFP中的生色基团结构如下图所示,下列有关GFP的说法中正确的是( )

A.该有机物属于芳香烃
B.1mol该有机物分子中含有7mol碳碳双键
C.该有机物与溴水既能发生加成反应,又能发生取代反应
D.该有机物所有原子都有可能共平面
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高一下学期期末考试化学试卷(解析版) 题型:填空题
(6分)现有如下两个反应:
A.NaOH + HCl = NaCl + H2O B.2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质, 判断能设计成原电池的是:_______,(填序号 )。
(2)不能的, 说明其原因_______________________________________________;(2分)
(3)如果可以, 写出负极材料及其电极反应式, 电解质溶液名称:
负极材料________,电极反应式_______________,电解质溶液名称____________,
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省上饶市第二学期期末教学质量测试高二化学试卷(解析版) 题型:选择题
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是
A.Na2O?Na2O2组成元素相同,推出与水反应产物也完全相同
B.SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强
C.H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO
D.根据常温下铜与浓硝酸反应可以制取NO2,推出常温下铁与浓硝酸反应也可以制取NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com