
分析 (1)平衡常数只与温度有关,升高温度平衡向吸热方向移动;
(2)所得混合溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(OH- )═c(H+);根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$;
(3)根据亚硫酸第一步电离平衡常数计算亚硫酸浓度;
(4)$\root{3}{\frac{Ksp[Fe(OH)_{3}]}{0.1}}$≤c(OH- )<$\sqrt{\frac{Ksp[Mg(OH)_{2}]}{0.1}}$.
解答 解:(1)a.平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,所以它们都能反映一定条件下对应变化进行的程度,故正确;
b.升高温度平衡向吸热方向移动,如果化学平衡正反应是放热反应,则升高温度化学平衡常数减小,故错误;
c.电离平衡常数只与温度有关,温度相同电离平衡常数相同,故错误;
d.一定温度下,在CH3COONa溶液中KW=Ka•Kh,故正确;
故选ad;
(2)所得混合溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(OH- )═c(H+),溶液呈中性;根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{5×1{0}^{-3}×1{0}^{-7}}{0.5a-5×1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:中;$\frac{1{0}^{-9}}{a-0.01}$;
(3)电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=$\frac{c({H}^{+})•c(HS{O}_{3}^{-})}{{K}_{a}}$=$\frac{0.001×0.1}{0.01}$mol/L=0.01 mol/L,故答案为:0.01 mol/L;
(4)$\root{3}{\frac{Ksp[Fe(OH)_{3}]}{0.1}}$≤c(OH- )<$\sqrt{\frac{Ksp[Mg(OH)_{2}]}{0.1}}$,$\root{3}{\frac{8.0×1{0}^{-38}}{0.1}}$mol/L≤c(OH- )<$\sqrt{\frac{1.0×1{0}^{-11}}{0.1}}$mol/L,2×10-13×$\root{3}{100}$mol/L≤c(OH- )<1×10-5mol/L,$\frac{1{0}^{-14}}{1{0}^{-15}}$mol/L<c(H+)≤$\frac{1{0}^{-14}}{2×1{0}^{-13}×\root{3}{100}}$mol/L,则3.3≤pH<9,
故答案为:3.3≤pH<9.
点评 本题考查较综合,涉及溶度积常数计算、弱电解质的电离、酸碱混合溶液定性判断等知识点,侧重考查学生分析计算能力,把握化学反应原理及难溶物溶解平衡是解本题关键,注意弱电解质电离平衡常数与其对应弱离子水解程度关系,题目难度中等.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下.11.2LNH3中含有N一H键的数目为1.5N | |
| B. | 足量的铜与含2mo1H2SO4的浓硫酸充分反应.可生成NA个SO2分子 | |
| C. | 标准状况下.将11.2LC12通人足量的石灰乳中制备漂白粉.转移的电子数为0.5NA | |
| D. | 常温常压下.21g氧气和27g臭氧所含的氧原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 HClO+H++Cl-.
HClO+H++Cl-.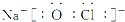 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
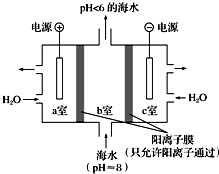
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常用电解法制备元素C、D、E的单质 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 化合物AE与CE具有相同类型的化学键 | |
| D. | 元素A、B组成的化合物常温下一定呈气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
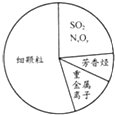
| A. | SO2、NxOy都属于酸性氧化物 | |
| B. | 碳氢化合物和氮氧化合物可引起光化学烟雾 | |
| C. | 重金属离子可导致蛋白质变性 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
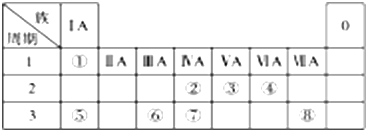
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ④ | ⑤ | ||||||
| 3 | ① | ② | ③ | ⑥ | ⑦ | ⑧ |
| 实验步骤 | 实验现象 |
| A、将一小块单质①放入滴有酚酞溶液 的冷水中 | 剧烈反应,①浮于水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| B、将单质②投入冷水中,观察现象, 再将水加热 | 开始无现象,加热后有气体产生 |
| C、将单质②投入稀盐酸中 | 迅速产生大量无色气体 |
| D、将单质③投入稀盐酸中 | 反应不十分剧烈,产生无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeS+浓HNO3 | B. | Cu+浓HNO3 | C. | FeO+HNO3 | D. | Fe2O3+HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com