
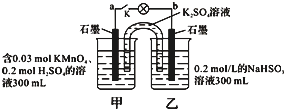
 如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )| A. | 当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a | |
| C. | 电池工作时,甲烧杯发生的反应为MnO4-+3e-+4H+═MnO2+2H2O | |
| D. | 乙池中的氧化产物为SO42- |
分析 图中装置为原电池,反应中高锰酸钾被还原,在酸性条件下生成Mn2+,甲中电极为原电池的正极,乙中亚硫酸钠被氧化,为原电池的负极,被氧化生成SO42-,结合电极方程式解答该题.
解答 解:A.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,则当电路中有1.204×1022个电子转移时,即0.02mol电子转移时,乙中生成0.03molH+,c(H+)=$\frac{0.03mol}{0.3L}$=0.1mol/L,故A正确;
B.甲为正极,电池工作时,阳离子移向正极,盐桥中的K+移向甲烧杯,外电路的电子方向是从b(负极)到a(正极),故B正确;
C.电池工作时,甲烧杯中MnO4-不断得到电子,变为Mn2+,消耗H+,故C错误;
D.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,氧化产物为SO42-,故D正确;
故选C.
点评 本题综合考查原电池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该题的关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
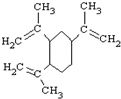
| A. | 榄香烯的分子式为C15H20 | |
| B. | 榄香烯属于芳香烃 | |
| C. | 榄香烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 | |
| D. | 1mol榄香烯最多能和3molH2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温下,0.1mol碳酸钠晶体中含有CO32-的个数为0.1NA | |
| C. | 标准状况下,11.2L18O2中所含中子数为8NA | |
| D. | 25℃时,1LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙可能由3种元素组成 | |
| B. | 若甲与乙中各元素质量比相同,则甲中一定含有氧元素 | |
| C. | 丙中一种元素原子的最外层电子数是内层电子总数的2倍,则丙一定是甲烷的同系物 | |
| D. | 若丁中为双原子分子,则丁中含有的化学键一定是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色原理相同 | |
| B. | 工业利用乙烯水化法制乙醇,是发生了取代反应 | |
| C. | 水果运输中为延长果实的成熟期,常在车厢里放置浸泡过高锰酸钾溶液的硅藻土 | |
| D. | 乙烯在空气中燃烧,发生火焰明亮并带有浓烟的火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 |
| A | 将钠加入到硫酸铜溶液中 | 有气泡冒出,有红色固体析出 |
| B | 将足量过氧化氢加入到硫酸亚铁溶液中 | 无明显变化 |
| C | 将过氧化钠投入氯化亚铁溶液中 | 最终生成红褐色沉淀 |
| D | 将氢氧化钠溶液逐滴滴入氯化亚铁溶液中 | 立即产生红褐色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当A一定时,K值越小,则元素的非金属性越强 | |
| B. | 当K=0,则该元素系同一周期中最活泼的金属元素 | |
| C. | 当n一定时,随着K值增大,则元素的非金属性逐渐增强 | |
| D. | 当K=l时,则该元素系过渡元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com