
| A. | R+ | B. | R2+ | C. | R3+ | D. | R2- |
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2d | B. | 2.5d | C. | 5d | D. | 10d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示.
室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
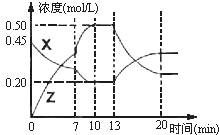 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )| A. | 化学方程式中a:b=1:3 | |
| B. | 推测在第7min时曲线变化的原因可能是升温 | |
| C. | 推测在第13min时该反应刚好达到化学平衡 | |
| D. | 用X表示O~10min内该反应的平均速率为v(X)=0.045mol•L-1•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +2nH2O.
+2nH2O. +2NaOH$→_{△}^{H_{2}O}$CH2=CHCOONa+HO-CH2-CH2-CH2-OH+NaBr.
+2NaOH$→_{△}^{H_{2}O}$CH2=CHCOONa+HO-CH2-CH2-CH2-OH+NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二次平衡时B为气态 | |
| B. | a>3 | |
| C. | 第一次平衡后增大压强平衡向左移动 | |
| D. | 第三次达到平衡时B可能为非气态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com