
【题目】25℃时,用0.1000mol·L-1的NaOH溶液分别滴定20.00mL均为0.1000mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法错误的是( )
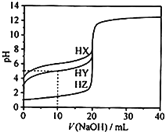
A.HZ是强酸,HX、HY是弱酸
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.向上述HY溶液中滴加任意NaOH溶液时,均存在c(H+)+c(Na+)=c(OH-)+c(Y-)
【答案】C
【解析】
A.0.1000mol·L-1的强酸会完全电离,一元酸则其pH为1,弱酸不完全电离,pH>1,根据图象,HX的pH为1,HY、HZ的pH>1,因此HX为强酸,HY、HZ为弱酸,故A正确;
B.用0.1000mol·L-1的NaOH溶液滴定20.00mL 0.1000mol·L-1的HY溶液,根据图象,当NaOH滴加10mL时,此时溶液中刚好生成NaY和HY物质的量1:1,可认为溶液中c(HY)≈c(Y-),HY的电离平衡常数为Ka(HY)=![]() ≈10-5,故B正确;
≈10-5,故B正确;
C.将上述HX、HY溶液等体积混合后,根据图象分析是HY的酸性强于HX,滴定反应先反应HY,用NaOH溶液滴定至HX恰好完全反应时,此时溶液中为NaX和NaY物质的量1:1关系,由于HY酸性强于HX,则水解程度NaX>NaY,则溶液中c(Y-)>c(X-),水解使溶液呈碱性,则c(OH-)>c(H+),则溶液中离子浓度关系应为:c(Y-)>c(X-)>c(OH-)>c(H+),故C错误;
D. 由电荷守恒,向上述HY溶液中滴加任意NaOH溶液时,均存在c(H+)+c(Na+)=c(OH-)+c(Y-),故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,已知X原子L层电子比M层电子多2个, Y3+离子电子层结构与Ne相同;Z与X处于同一周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出元素X名称:________ ;
(2)写出Y元素在元素周期表的位置_______________ ;
(3)画出元素Z的原子结构示意图:___________________ ;
(4)Z元素所在主族的元素形成的含氧酸酸性最强的是(写化学式)____________;
(5)X的氢化物的电子式为______________;
(6)写出Y单质与氢氧化钠溶液反应化学方程式_________________;
(7)标准状况下,2.24LZ单质与足量氢氧化钙完全反应时,电子转移总数为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧0.1 mol某有机物得0.2 mol CO2和0.3 mol H2O,由此得出的结论不正确的是( )
A. 该有机物分子的结构简式为CH3—CH3
B. 该有机物中碳、氢元素原子数目之比为1∶3
C. 该有机物分子中不可能含有![]() 双键
双键
D. 该有机物分子中可能含有氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq) + I-(aq) ![]() I3-(aq)。某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
I3-(aq)。某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
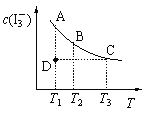
A.反应 I2(aq) + I-(aq) ![]() I3-(aq)的△H>0
I3-(aq)的△H>0
B.状态A与状态B相比,状态A的c(I2)大
C.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2
D.若反应进行到状态D时,一定有v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入![]() 溶液,所加NaOH溶液的体积
溶液,所加NaOH溶液的体积![]() 与产生沉淀的物质的量
与产生沉淀的物质的量![]() 关系如下图所示,下列说法不正确的是
关系如下图所示,下列说法不正确的是 ![]()
![]()

A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应溶液的体积为![]()
C.b点与a点的差值为![]()
D.样品中铝粉和铁粉的物质的量之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:
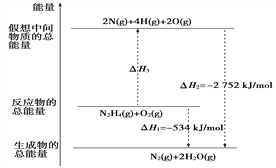
A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池又称为“摇摆电池”,广泛使用于电动自行车等,其充放电过程就是锂离子的嵌入和脱嵌过程(习惯上正极用嵌入或脱嵌表示,负极用插入或脱插表示),即充放电过程就是锂离子在正、负极间往返运动而形成电流。其装置结构简图如图所示(电解液为溶有LiPF6的碳酸酯类溶剂,隔膜为仅有锂离子能通过的高分子膜),工作原理为C6Li+Li(1-x)MO2![]() LiMO2+C6Li(1-x)(M代表过渡元素),则下列说法错误的是( )
LiMO2+C6Li(1-x)(M代表过渡元素),则下列说法错误的是( )

A.电池放电时,正极为石墨
B.锂离子电池的优点是质量小,电容量大,可重复多次使用
C.电池充电时阳极的反应为LiMO2-xe-=Li(1-x)MO2+xLi+
D.锂离子电池的电解液不能是水溶液,因为锂是活泼金属,能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应N2(g)+3H2(g)![]() 2NH3(g),若N2、H2、NH3的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2NH3(g),若N2、H2、NH3的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A.C1:C2=1:3
B.平衡时,H2和NH3的生成速率之比为2:3
C.N2、H2的转化率之比为1:3
D.C1的取值范围为0.04 mol·L-1<C1<0.14 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com