
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | Ne | |||
| 3 | Na | Al | P | S | Cl |
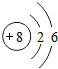 ,
,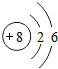 ;
;

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:
 铜单质及其化合物在工业生产和科研中有重要作用.
铜单质及其化合物在工业生产和科研中有重要作用.| 金属离子 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) |
1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| c(CO)-c(H2) |
| c(H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com