

| m |
| V |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 2 |
| ||
(
|
720
| ||
| NAd3 |
720
| ||
| NAd3 |


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:

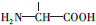 b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、SiO2与干冰的晶体结构相似 |
| B、SiO2耐腐蚀,不与任何酸反应 |
| C、工业上用SiO2制备粗硅 |
| D、光纤主要成分是SiO2,具有导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 纯碱是强碱弱酸盐 | 用纯碱溶液可清洗油污 |
| B | 不锈钢是合金 | 不锈钢在潮湿环境中容易被腐蚀 |
| C | Fe2O3是碱性氧化物 | Fe2O3可用作红色油漆和涂料 |
| D | NO2是红棕色气体 | 常温下可用铜与浓硝酸制取NO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ,请写出其涉及的反应(注明反应的条件
,请写出其涉及的反应(注明反应的条件查看答案和解析>>
科目:高中化学 来源: 题型:
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.| n(H2) |
| n(CO2) |
2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、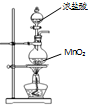 用装置制取氯气 |
B、 用装置除去氯气中的少量氯化氢和水蒸气 |
C、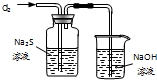 用装置可证明Cl2的氧化性强于S |
D、 用装置可以完成“喷泉”实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其浓溶液如果不慎沾在皮肤上,应立即用酒精擦洗 |
| B、其水溶液显强酸性,俗称石炭酸 |
| C、超过65℃可以与水以任意比互溶 |
| D、纯净的苯酚是无色晶体,在空气中易被氧化而呈粉红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com