
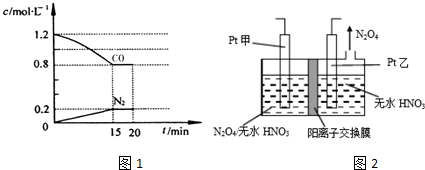
���� ��1���ٸ���v=$\frac{��c}{��t}$����v��N2��������Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȼ���NOŨ�ȱ仯�����ٸ���n=cV����μӷ�ӦNO�����ʵ�������������NO��ת���ʣ�
��a����С���������ѹǿ����ƽ��������Ӧ�����ƶ����ƶ������������COŨ������
b������CO������CO��Ũ������
c�������¶ȣ�ƽ��������Ӧ�����ƶ���
d���������������ѹǿ��С��ƽ�����淴Ӧ�����ƶ���ƽ��ʱCOŨ�ȼ�С��
���¶Ȳ��䣬ƽ�ⳣ�����䣬��������ʽ����ƽ��ʱ����ֵ�Ũ�ȣ�����ƽ�ⳣ��K=$\frac{{c}^{2}��C{O}_{2}����c��{N}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$���ټ����ʱŨ����Qc����ƽ�ⳣ����ȣ��жϷ�Ӧ���з���
��2������CO��ȼ������дCOȼ�յ��Ȼ�ѧ����ʽ�����ݸ�˹���ɣ�����֪�Ȼ�ѧ����ʽ���Ժ��ʵ�ϵ�����мӼ�����Ŀ���Ȼ�ѧ����ʽ����Ӧ��Ҳ������Ӧ�ļ��㣻
��3����ͼ��֪���ҵ缫�����������������ɣ�������ԭ��Ӧ������Ϊ�������ʼ�Ϊ������N2O4������ʧȥ���ӣ�����������������N2O5�����ݵ���غ��֪���������������ɣ�
��� �⣺��1������ͼ��֪��15min N2��Ũ�ȱ仯��Ϊ0.2mol/L����v��N2��=$\frac{0.2mol/L}{15min}$=0.013mol/��L•min����
Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ���NOŨ�ȱ仯��Ϊ2��0.2mol/L=0.4mol/L���ʲμӷ�Ӧ��NOΪ2L��0.4mol/L=0.8mol����NO��ת����Ϊ$\frac{0.8mol}{2mol}$��100%=40%��
�ʴ�Ϊ��0.013mol/��L•min����40%��
��a����С���������ѹǿ����ƽ��������Ӧ�����ƶ����ƶ������������COŨ������ƽ��ʱCOŨ������a����
b������CO������ƽ����Ȼ������Ӧ�����ƶ�����CO��ת���ʼ�С����ƽ��ʱCO��Ũ������b����
c�������¶ȣ�ƽ��������Ӧ�����ƶ���������ƽ��ʱCO��Ũ�ȼ�С����c��ȷ��
d���������������ѹǿ��С��ƽ�����淴Ӧ�����ƶ�����CO�����ʵ�������̶�С���������̶ȣ�����COŨ�ȼ�С��
��ѡ��cd��
��ƽ��ʱ����Ũ�ȱ仯��Ϊ0.2mol/L��NO����ʼŨ��Ϊ$\frac{2mol}{2L}$=1mol/L��CO����ʼŨ��Ϊ$\frac{2.4mol}{2L}$=1.2mol/L����
2NO��g��+2CO��g��?2CO2��g��+N2��g��
��ʼ��mol/L����1 1.2 0 0
ת����mol/L����0.4 0.4 0.4 0.2
ƽ�⣨mol/L����0.6 0.8 0.4 0.2
��ƽ�ⳣ��K=$\frac{{c}^{2}��C{O}_{2}����c��{N}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$=$\frac{0��{4}^{2}��0.2}{0��{6}^{2}��0��{8}^{2}}$L/mol=$\frac{5}{36}$L/mol��
20minʱ���������г���NO��N2��0.4mol����ʱŨ����Qc=$\frac{0��{4}^{2}����0.2+\frac{0.4}{2}��}{��0.6+\frac{0.4}{2}��^{2}��0��{8}^{2}}$=$\frac{5}{32}$��K=$\frac{5}{36}$���ʷ�Ӧ���淴Ӧ���У��������ƶ���
�¶Ȳ��䣬ƽ�ⳣ�����䣬�����´ﵽƽ��÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ$\frac{5}{36}$L/mol��
�ʴ�Ϊ������$\frac{5}{36}$L/mol��
��2������2CO��g��+2NO��g��?N2��g��+2CO2��g����H=-a kJ•mol-1
��2NO��g��+O2��g��=2NO2��g����H=-b kJ•mol-1��
��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-c kJ•mol-1
���ݸ�˹���ɣ���-��+2���۵ã�4CO��g��+2NO2��g��?N2��g��+4CO2��g����H=-a+b-2c kJ•mol-1��
�ʴ�Ϊ��4CO��g��+2NO2��g��?N2��g��+4CO2��g����H=-a+b-2c kJ•mol-1��
��3����ͼ��֪���ҵ缫�����������������ɣ�������ԭ��Ӧ������Ϊ�������ʼ�Ϊ������N2O4������ʧȥ���ӣ�����������������N2O5�����ݵ���غ��֪���������������ɣ�����������N2O5�ĵ缫��Ӧʽ�ǣ�N2O4+2HNO3-2e-=2N2O5+2H+��
�ʴ�Ϊ������N2O4+2HNO3-2e-=2N2O5+2H+��
���� ���⿼�黯ѧƽ���йؼ��㡢��ѧƽ���ƶ�����ѧ��Ӧ���ʼ��㡢ƽ�ⳣ�����㼰Ӧ�á��Ȼ�ѧ����ʽ��д�����ԭ�����缫��Ӧʽ��д�ȣ�����ƴ������Ŀ����ѧƽ�ⳣ�����йؼ����Ǹ߿��ȵ㣬�������ջ�ѧƽ�ⳣ����Ũ���̵Ĺ�ϵȷ����Ӧ����1���Т�Ϊ�״��㣬ѧ��������ƽ���ƶ��ж�Ũ�ȱ仯��ע���ƽ���ƶ�ԭ�������⣺�������ı䡱�����ǡ������ı䡱��Ҳ���Խ���ƽ�ⳣ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ksp��AB2��С��Ksp��CD����˵��AB2���ܽ��һ��С��CD���ܽ�� | |
| B�� | ������Ԫ���⣬������Ԫ�ص�����ϼ�����ֵ�϶����ڸ�Ԫ�������������� | |
| C�� | 2C+SiO2$\frac{\underline{\;����\;}}{\;}$Si+2CO�����˷�Ӧ�ܹ���������Ϊ̼�Ļ�ԭ�Աȹ�ǿ | |
| D�� | ����Ҳ����ͨ�����ֽⷴӦ��ǿ�ᣬ�磺H2S+CuSO4=H2SO4+CuS�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | ||
| C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 6�� | B�� | 10�� | C�� | 12�� | D�� | 14�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�14 g C2H4��C3H6�Ļ�������к���̼ԭ�ӵ���ĿΪNA | |
| B�� | �����£�pH=12��Na2CO3��Һ�к��е�OH-������Ϊ0.01NA | |
| C�� | ��״���£�0.56 L�����к��й��ۼ�����ĿΪ0.2 NA | |
| D�� | 7.8 g Na2O2�к��е���������Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʯ��ˮ�м���һ������ʯ�ң��¶��������ߣ�������Һ��pH���� | |
| B�� | AgCl����Һ�д���ƽ�⣺AgCl��s���TAg+��aq��+Cl-��aq���������м�������NaCl��ĩ��ƽ�������ƶ�����Һ�����ӵ���Ũ�Ȼ��С | |
| C�� | AgCl����Һ�м���KI��Һ����ɫ������ɻ�ɫ��֤����������Ksp��AgCl����Ksp��AgI�� | |
| D�� | Ӳˮ�к��н϶��Ca2+?Mg2+?HCO3-��SO42-��������п�����ȫ��ȥ���е�Ca2+?Mg2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | b=c | |
| B�� | RԪ��λ�����ڱ��Ģ�A�� | |
| C�� | �ζ��յ�ʱ����Һ����ɫ����ɫ��Ϊ��ɫ | |
| D�� | ���ζ�����Na2S2O3��Һ20.00mL����Ӧ��ת�Ƶ���6.02��1020�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=a�İ�ˮ��Һ��ϡ��10������pH=b����a=b+1 | |
| B�� | ��NaAlO2��Һ�еμ�NaHCO3��Һ���г������������� | |
| C�� | ��Na2C2O4ϡ��Һ�У�c��OH-��=c��H+��+c��HC2O4-��+2c��H2C2O4�� | |
| D�� | 0.1 mol/L Na2CO3��Һ��0.1 mol/L NaHCO3��Һ�������ϣ�3c��Na+��=2[c��CO32-��+c��HCO3-��+c��H2CO3��] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ���� | ���� |
| A | �ɴ�������Ƶ����� | ���ԣ�HClO��HCl |
| B | ԭ����и��������Ļ�ԣ�������ǿ | þ�������缫��NaOH��Һ���ԭ���ʱ��þ������ |
| C | -OH����Na��Ӧ����H2 | ��ͨ�����������Ƿ�������ݲ����ķ��������Ҵ���ˮ��Һ�������ˮ��Һ |
| D | �ܽ��С�ij��������С�ij���ת�� | ��AgCl����Һ�еμ�KI��Һ�ɵõ�AgI���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com