
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3
C.工业制取金属钾Na(l)+KCl(l) NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
D.加入催化剂有利于氨的合成
【答案】D
【解析】
A.二氧化氮与四氧化二氮之间存在化学平衡2NO2![]() N2O4,红棕色的NO2加压后颜色先变深是因为加压后二氧化氮的浓度变大了,后来变浅说明化学平衡向生成四氧化二氮的方向移动了,A可以用平衡移动原理解释;
N2O4,红棕色的NO2加压后颜色先变深是因为加压后二氧化氮的浓度变大了,后来变浅说明化学平衡向生成四氧化二氮的方向移动了,A可以用平衡移动原理解释;
B.合成SO3的反应是气体分子数减小的反应,加压后可以使化学平衡向正反应方向移动,所以高压比常压有利于合成SO3的反应,B可以用平衡移动原理解释;
C.工业制取金属钾,Na(l)+KCl(l)![]() NaCl(l)+K(g),选取适宜的温度,使K成蒸气从反应混合物中分离出来,有利于化学平衡向生成钾的方向移动,C可以用平衡移动原理解释;
NaCl(l)+K(g),选取适宜的温度,使K成蒸气从反应混合物中分离出来,有利于化学平衡向生成钾的方向移动,C可以用平衡移动原理解释;
D.加入催化剂可以加快化学反应速率,所以有利于氨的合成,但是不可以用平衡移动原理解释,D符合题意;
故选D。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑧ | ⑩ | |||||
三 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
四 | ② | ④ |
(1)在这10种元素中,化学性质最不活泼的元素是________ (写序号),得电子能力最强的原子是________ (用元素符号表示);元素⑦的最高价氧化物对应的水化物是________________ (写化学式)。
(2)元素④的离子结构示意图为________________。
(3span>)①⑧⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示) ________________。
(4)请写出:
(i)③的单质置换出⑥的单质的化学方程式: ________________________。
(ii)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为____________________。
(iii)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)石油和煤是重要的能源物质,下列说法错误的是___。
a.石油和煤是不可再生能源
b.煤为混合物,含有苯、甲苯、二甲苯等有机物
c.煤的干馏和石油的分馏都是物理变化
d.煤燃烧及汽车尾气是造成空气污染的重要原因
e.以煤、石油为原料可生产塑料、合成橡胶、合成纤维等合成材料
(2)以煤为原料经过一系列反应可生产乙酸乙酯,其合成路线如下:
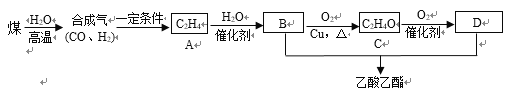
①C的名称是______;A→B的反应类型是_______。
②决定化合物B性质的基团名称是_________。
③B→C的化学方程式为_______________________________。
B+D→乙酸乙酯的化学方程式为________________________________。
(3)某化学实验小组的同学,采用如图装置制取乙酸乙酯。

①仪器B的名称是_______;仪器A中冷却水的进口是_____(填“a”或“b”)。
②观察仪器A的内层结构,与长直导管相比较,该反应装置的优点是_______。
③将乙醇和乙酸按照物质的量3∶2混合得到258g混合液,在浓硫酸作用下发生反应,乙酸乙酯的产率为50%,则生成的乙酸乙酯的质量是_______g。(相对分子质量:乙醇—46,乙酸—60,乙酸乙酯—88)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某含镍废料(主要成分为NiO,还含有少量FeO、Fe2O3、CoO、SiO2)为原料制备NixOy和碳酸钴的工艺流程如下:

(1)“酸溶”时需将含镍废料粉碎,目的是_________________________________;“滤渣Ⅰ”主要成分为____________________(填化学式)。
(2)“氧化”中添加NaClO3的作用是_______________________,为证明添加NaClO3已足量,可用_______________(写化学式)溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀,其离子方程式为__________________。
(4)“沉钴”过程的离子方程式________________________。若“沉钴”开始时c(Co2+)=0.10 mol/L,则控制pH≤_____________时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3)
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,______________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物的化学式为__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂用闪锌矿制备锌及颜料 A(红棕色固体)的工艺流程如下图所示。(闪锌矿的主要成分为 ZnS,同时含有 10%的 FeS 及少量 CuS)
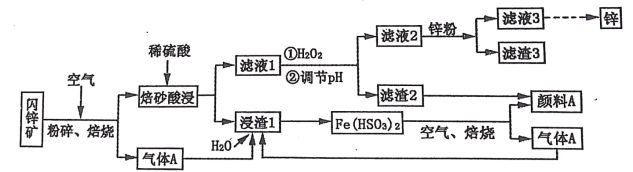
已知:①闪锌矿在焙烧时会生成副产物 ZnFeO4,ZnFeO4 不溶于水及硫酸。Fe(HSO3)2 难溶于水。②Ksp[Fe(OH)3]=1×10-39。
完成下列问题
(1)闪锌矿粉碎的目的是_______________________________________________________。
(2)“滤液 1”中选用足量的 H2O2,理由是_____________________。假设“②调节 pH"前,滤液 1 中 c(Fe3+)=1molL-1 ,则 Fe3+ 完全沉淀时的 pH 至少为____________________。(离子浓度≤ 10-6mol·L-1 规为完全除去)。
(3)“滤渣 3”的成分为__________________________________ (写化学式)。
(4)设计一种检验“颜料 A”中是否含有 Fe2+的实验方案_______________________________________________________。
(5)“气体 A”与“浸渣 1”反应的化学方程式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为主要原料可以制备乙二醇,相关工艺流程如下:
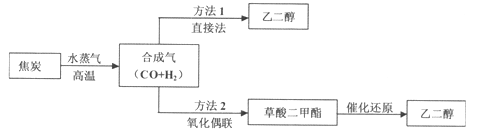
(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式_______
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是_____填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成份为CH4)与C02反应制备合成气。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
则CH4与CO2生成合成气的热化学方程式为____________________。
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
CH3OOC—COOCH3(g)+ 4H2(g)![]() HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O![]() HOOC—COOH+2CH3OH
HOOC—COOH+2CH3OH
①草酸是二元弱酸,可以制备![]() (草酸氢钾),
(草酸氢钾),![]() 溶液呈酸性,用化学平衡原理解释:__________________。
溶液呈酸性,用化学平衡原理解释:__________________。
②在一定的![]() 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
A.![]()
B.![]()
C.![]()
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的_____填“正”或“负”)极,负极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为原料制备某些物质的转化关系如下图所示(图中部分反应条件及生成物未给出)。

(1)检验有机物C中官能团的常用试剂是________________________(写出一种即可)。
(2)写出反应③的化学方程式____________________________。
(3)有机物E有多种同分异构体,写出与E属于同类物质的同分异构体的结构简式(不包括E)____________、____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g) + 5O2 (g) ![]() 4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
② 4NH3 (g) + 4O2 (g) ![]() 2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
③ 4NH3 (g) + 3O2 (g) ![]() 2N2 (g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
2N2 (g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
下列说法正确的是
A.增大压强,则反应的②K不变,反应①和③的K减小
B.500℃时,2NH3 (g) + 2O2 (g) ![]() N2O (g) + 3H2O (g) K=2.2×1028
N2O (g) + 3H2O (g) K=2.2×1028
C.500℃时,N2 (g) + O2 (g)= 2NO (g) △H = +181 kJ·mol-1
D.500℃时,2 mol NH3 与2.5 mol O2混合发生反应①,可放出热量453.6 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com