
| △c |
| △t |
| 115g |
| 92g/mol |
| 92g/mol×(1.25-x)mol+46g/mol×2xmol |
| (1.25-x+2x)mol |
| △c |
| △t |
| ||
| 2s |
| 115g |
| 92g/mol |
| 92g/mol×(1.25-x)mol+46g/mol×2xmol |
| (1.25-x+2x)mol |


科目:高中化学 来源: 题型:
| A、标准状况下,22.4L盐酸含有个NA HCl分子 |
| B、常温下,4.4g CO2和N2O混合物中所含有的原子数为0.3NA |
| C、0.2mol Cl2溶解于等体积的水中,转移电子数为0.1NA |
| D、标准状况下,11.2L四氯化碳所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥⑧⑩ |
| B、①④⑤⑥⑧⑨ |
| C、①②④⑥⑧⑨ |
| D、②③④⑤⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成SO3为2mol |
| B、SO2和SO3物质的量之和一定为3mol |
| C、放出197kJ 的热量 |
| D、SO2 的物质的量和SO3物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
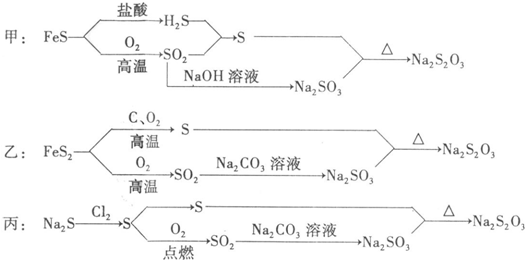
查看答案和解析>>
科目:高中化学 来源: 题型:
 +NaOH
+NaOH| 醇 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
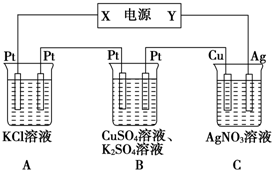 如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
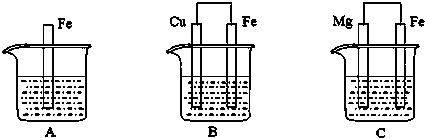
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com