
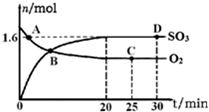
 硫的化合物在生产和科研中发挥着重要作用.
硫的化合物在生产和科研中发挥着重要作用.| c(Cl2).c(SO2) |
| c(SO2Cl2) |
| 97.3kJ |
| 1mol |
| 0.18mol |
| 1L |
| 0.20mol-0.18mol |
| 1L |
| c(Cl2).c(SO2) |
| c(SO2Cl2) |
| 0.18×0.18 |
| 0.02 |
| ||
| △t |
| ||
| 20min |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ |
| C、大理石溶于醋酸中的反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2溶液 |
| B、溴水 |
| C、酸性高锰酸钾溶液 |
| D、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
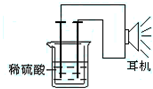 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | |||||||||||||||
| a | b | c | d | ||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com