
【题目】25℃时有三瓶溶液: pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是( )
A.中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积
B.往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全
C.将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-)
D.25℃时pH=3的盐酸、pH=11的NaOH溶液中水电离出的c(H+)均为10-11 mol/L
【答案】D
【解析】
A. 醋酸是一元弱酸,存在电离平衡,当溶液pH相等时,醋酸浓度大于盐酸的浓度,所以中和等体积、等pH的NaOH溶液,消耗醋酸溶液的体积小于盐酸的体积,A错误;
B. 醋酸是一元弱酸,存在电离平衡,当溶液pH相等时,醋酸浓度大于盐酸的浓度,向上述两种溶液中分别加入相同的锌粒,醋酸电离平衡正向移动,反应过程中醋酸的浓度大于盐酸的浓度,所以醋酸中的锌粒先反应完全,B错误;
C. 在醋酸与NaOH反应得到的溶液pH=7,c(H+)=c(OH-),由于反应后混合溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(Na+)=c(CH3COO-),C错误;
D. 酸电离产生的H+、碱电离产生的OH-对水的电离平衡起抑制作用,等浓度的H+、OH-对水的电离平衡抑制作用相同。25℃时pH=3的盐酸c(H+)=10-3 mol/L,水电离出的c(H+)水=c(OH-)水=![]() mol/L=
mol/L=![]() mol/L=10-11 mol/L;pH=11的NaOH溶液中c(OH-)=
mol/L=10-11 mol/L;pH=11的NaOH溶液中c(OH-)=![]() mol/L=
mol/L=![]() mol/L=10-3 mol/L,溶液中H+就是水电离产生的,所以水电离出的c(H+)水=10-11 mol/L,故两种溶液中水电离出的c(H+)均为10-11 mol/L,D正确;
mol/L=10-3 mol/L,溶液中H+就是水电离产生的,所以水电离出的c(H+)水=10-11 mol/L,故两种溶液中水电离出的c(H+)均为10-11 mol/L,D正确;
故答案选D。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量的混合气体发生反应xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变.将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变.将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
A.B的转化率降低B.平衡向正反应方向移动
C.x+y<zD.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1.00mol NaCl中含有6.02×1023个NaCl分子
B. 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C. 欲配置1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D. 电解58.5g熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 弱酸酸式盐NaHB在水溶液中水解:HB–+H2O ![]() H3O++B2–
H3O++B2–
B. 硫化钠水解: S2- + 2H2O = H2S↑+2OH-
C. 碳酸钠溶液显碱性:CO32-+H2O ![]() HCO3-+OH-
HCO3-+OH-
D. 制备氢氧化铁胶体:Fe3+ +3H2O ![]() Fe(OH)3(胶体) + 3H+
Fe(OH)3(胶体) + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知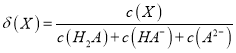 ]。
]。
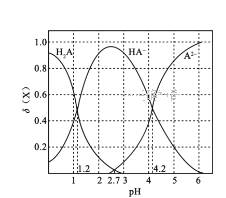
下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空.

(1)A的结构简式是___,名称是_____.比A少2个碳原子的同系物中,写出其同分异构体是链烃的结构简式____.
(2)①的反应类型是____,③的反应类型是___.
(3)反应④的化学方程式是___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定体积的密闭容器中,可逆反应,nA(g)+mB(g)![]() pC(g)已经达到平衡状态。已知n+m>p,ΔH<0。下列分析结论中正确的是( )
pC(g)已经达到平衡状态。已知n+m>p,ΔH<0。下列分析结论中正确的是( )
①升温,![]() 的值变小;②降温,平衡体系内混合气体的平均相对分子质量变小;③增加B的物质的量,A的转化率增大;④使用催化剂,气体总的物质的量不变;⑤加压使密闭容器的容积变小,A或B的浓度则变大;⑥若A的反应速率为v(A),则v(B)=
的值变小;②降温,平衡体系内混合气体的平均相对分子质量变小;③增加B的物质的量,A的转化率增大;④使用催化剂,气体总的物质的量不变;⑤加压使密闭容器的容积变小,A或B的浓度则变大;⑥若A的反应速率为v(A),则v(B)=![]() v(A)
v(A)
A.①②B.②③④C.③④⑤D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 恒温恒压下,在容积可变的器皿中,反应2NO2 (g)![]() N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A.减小 B.增大 C.不变 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com