
【题目】已知:CH3CH=CH2+HBr→CH3-CHBr-CH3(主要产物),1mol某烃充分燃烧后得8mol CO2 和4mol H2O ,该烃A在不同条件下能发生如下变化
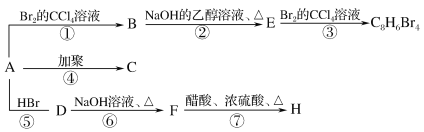
(1)A的化学式:________,A的结构简式:________。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出C、D、E、H物质的结构简式:C_____,D_______,E_______,H________。
(4)写出D→F反应的化学方程式_______________________________。
【答案】C8H8 ![]() 加成反应 酯化(或取代)反应
加成反应 酯化(或取代)反应 ![]()
![]()
![]()
![]()
![]()
【解析】
1mol烃燃烧得到8molCO2和4molH2O,则该烃的分子中含有8molC和8molH,分子式为C8H8。C8H8比辛烷少了10个H,但是E与溴加成后分子中只能增加4个溴原子,则可以推断A分子中含有1个苯环,侧链有两个C,且含有碳碳双键。A到B为和Br2发生加成,B发生取消反应,生成碳碳三键,再和2molBr2加成。A和HBr发生加成得到D,D发生取代生成醇,再与醋酸发生酯化反应。
(1) 1mol烃燃烧得到8molCO2和4molH2O,则该烃含有8molC和8molH,分子式为C8H8。C8H8比辛烷少了10个H,但是E与溴加成后分子中只能增加4个溴原子,则可以推断A分子中含有1个苯环,侧链有两个C,且含有碳碳双键,结构简式为![]() ;
;
(2)上述反应中,反应①是A与Br2的CCl4溶液发生加成反应;反应⑦中F在浓硫酸作催化剂、加热的条件下和乙酸发生酯化反应(取代反应);
(3) ![]() 发生加聚反应,碳碳双键打开得到高分子化合物C,结构简式为
发生加聚反应,碳碳双键打开得到高分子化合物C,结构简式为![]() ;A和HBr发生加成,根据已知Br连接到与苯环相连的第一个碳上,得到D,结构简式为
;A和HBr发生加成,根据已知Br连接到与苯环相连的第一个碳上,得到D,结构简式为![]() ;A到B为和Br2发生加成,B发生取消反应,生成碳碳三键得到E,结构简式为
;A到B为和Br2发生加成,B发生取消反应,生成碳碳三键得到E,结构简式为![]() ;A和HBr发生加成得到D,D发生取代生成醇,再与醋酸发生酯化反应生成F,结构简式为
;A和HBr发生加成得到D,D发生取代生成醇,再与醋酸发生酯化反应生成F,结构简式为![]() ;
;
(4)D的结构简式为 ![]() ,其在NaOH水溶液中加热,发生的是卤代烃的水解反应,生成醇,答案为
,其在NaOH水溶液中加热,发生的是卤代烃的水解反应,生成醇,答案为![]() 。
。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】盐酸利多卡因(F)可用于表面麻醉,还具有抗心律失常的作用,其合成路线:

回答下列问题:
(1)A的化学名称为______________,B→C的反应类型为____________。
(2)C→D的化学方程式为___________________。
(3)E中苯环上的一氯代物有___________种。
(4)X为B的芳香族同分异构体且苯环上仅有2个取代基,红外光谱显示X有氨基(-NH2),实验测得X能与NaHCO3溶液发生反应生成CO2,则X的结构可能有______种,其中一种核磁共振氢谱峰面积比为2:2:2:2:1的X的结构简式为______________________。
(5)已知工业上可用氯气催化乙酸生产氯乙酸,再以氯乙酸为原料,以S2Cl2、Cl2为氯化剂,加入适当的催化剂,即可制得氯乙酰氯(ClCH2COCl)。请设计以CH2=CH2为主要原料合成ClCH2COCl的路线流程图________________________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是
A.15g甲基(-CH3)中含有的电子数为9NA
B.标准状况下,2.24L辛烷中所含碳原子数为0.8NA
C.1.8gH2O与D2O的混合物中含有的质子数和电子数均为NA
D.—定条件下,密闭容器中2molSO2(g)与1molO2(g)充分反应,则容器中分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
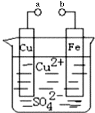
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铁片上发生的反应为:Fe-2e-=Fe2+
C. a和b用导线连接时电子从Cu片流向铁片
D. a和b用导线连接时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,2012年俄罗斯科学家再次合成117号元素。本次实验生成了6个新原子,其中5个![]() ,1个
,1个![]() 。下列关于
。下列关于![]() 和
和![]() 的说法不正确的是
的说法不正确的是
A. 是元素X的两种不同核素 B. 电子数相差1
C. 中子数分别为176和177 D. 它们互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2.0L的恒容密闭容器中充入3.0molCl2和4.0molPCl5,473K 时发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)△H= 92.5 kJ·mol-1,各物质的物质的量随时间变化关系如图所示:
PCl3(g)+Cl2(g)△H= 92.5 kJ·mol-1,各物质的物质的量随时间变化关系如图所示:
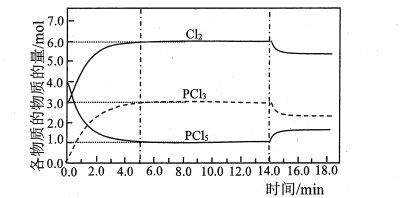
下列说法正确的是
A.0.0~5.0min,PCl5分解的平均速率为0.6mol·L-1·min -1
B.起始时,若用3.0mol37Cl2和4.0mol P35Cl5,达平衡时,PCl3 中不含37C1
C.图中14.0min时,改变的外界条件可能是缩小容器的体积
D.若在14.0min时,向容器中各充入1.0mol 的Cl2、PCl5 及PCl3,维持其他条件不变,重新达到平衡前,v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组采用如下方案拆解废钴酸锂电池并从拆解的正极片中回收锂和钴,主要的实验流程如下:

已知:①正极片中主要含LiCoO2(难溶于水)以及少量乙炔炭黑及铝箔等;负极为石墨,充电时Li+嵌入石墨电极。
②P2O4为磷酸二异辛酯,密度为0.973g.cm-3。
③3HBrO+CO(NH2)2=3HBr+N2↑+2H2O+CO2↑。
(1)“放电处理”时,有关说法正确的是__________(填标号)。
A.有利于锂的回收,提高锂的回收率
B.处理的主要目的是回收残余的电能
C.处理过程中产生的气体只有O2
D.可防止在电池拆解过程中,发生短路引起火灾、爆炸事故等安全问题
(2)“还原浸取”时,发生反应的离子方程式为_____________(S2O32-被氧化为SO42-)。
(3)“除铁、铝”时,应调整溶液的pH范围为___________(下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。

(4)“萃取”与“反萃取”时,静置后(如图所示),获得有机相的操作方法是__________;“反萃取”试剂X适宜是___________(填“H2SO4”或“NaOH”)溶液。

(5)设计以流程中产品Li2CO3为原料,制取LiBr·H2O的实验方案:向烧杯中加入适量冷水,______________,干燥得LiBr·H2O[实验中必须使用的试剂:饱和溴水、尿素及活性炭]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学小组制备硝基苯的实验装置如下,有关数据列如下表。已知存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。

物质 | 熔点/℃ | 沸点/℃ | 密度/g.cm-1 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
实验步骤如下:
取100mL烧杯,用20 mL浓硫酸与足量浓硝酸配制混和酸,将混合酸小心加入B中。把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
(1)图中装置C的作用是_______________________________。
(2)制备硝基苯的化学方程式__________________________________________________。
(3)叙述配制混合酸操作:______________________________________________。
(4)为了使反应在50℃~60℃下进行,常用的方法是______________。反应结束并冷却至室温后A中液体就是粗硝基,粗硝基苯呈黄色的原因是________________________(用化学方程式说明),除去该有色物质选择的试剂是____________,分离提纯的方法为___________,涉及的离子方程式为_______________。
(5)在洗涤操作中,第二次水洗的作用是________________________________________。
(6)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是_______________________________________________________________。
(7)本实验所得到的硝基苯产率是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com