
【题目】表为元素周期表的一部分,其中的编号代表所对应的元素.请回答下列问题: 
(1)⑧号元素的基态原子的价电子排布式是 , 与其同周期,且基态原子的核外未成对电子数最多的元素是(写出元素符号).
(2)④号与⑦号元素形成的氧化物的熔点由高到低的是 .
(3)①号与③号元素形成的含有18电子的分子为(写出名称),该分子中③号元素的原子的杂化方式为 . ②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为(用对应的元素符号表示). 
(4)下表是某些短周期元素的电负性值:
元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
电负性 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.1 |
①通过分析电负性值变化规律,确定N最接近的电负性值范围:<N< .
②推测电负性值与原子半径关系是 .
③试推断:AlBr3中化学键类型是 .
【答案】
(1)3d84s2;Cr
(2)MgO>CaO
(3)过氧化氢;sp3;MgNi3C
(4)2.5;3.5;半径越大,电负性值越小;共价键
【解析】解:由元素在周期表中位置,可知①为H,②为C,③为O,④为Na,⑤为Al,⑥为Cl,⑦为Ca,⑧为Ni,⑨为Cu.
(1.)⑧号元素核外电子数为28,基态原子的价电子排布式是3d84s2;与其同周期,且基态原子的核外未成对电子数最多的元素的外围电子排布为3d54s1 , 为Cr元素,所以答案是:3d84s2;Cr;
(2.)氧化镁、氧化钙均为离子晶体,离子所带电荷相等,镁离子半径小于钙离子半径,故MgO的晶格能大于CaO的,故熔点MgO>CaO,所以答案是:MgO>CaO;
(3.)①号与③号元素形成的含有18电子的分子为H2O2 , 该分子中O原子形成2个σ键、含有2对孤对电子,杂化轨道数目为4,O原子采取sp3杂化,晶胞中C原子数目为1,Ni原子数目为6× ![]() =3,Mg原子数目为8×
=3,Mg原子数目为8× ![]() =1,故化学式为MgNi3C,所以答案是:过氧化氢;sp3;MgNi3C;
=1,故化学式为MgNi3C,所以答案是:过氧化氢;sp3;MgNi3C;
(4.)①同一周期从左至右,随着核电荷数的递增电负性值递增;同族元素从上到下,随着原子半径的增大元素电负性值递减,N最接近的电负性值范围:2.5<N<3.5,
所以答案是:2.5;3.5;
②同周期自左而右原子半径减小、电负性增大,同主族自上而下原子半径增大、电负性减小,可推知半径越大,电负性值越小,所以答案是:半径越大,电负性值越小;
③氯化铝属于共价化合物,Br的电负性小于Cl的,Al与Br的电负性之差更小,则AlBr3属于共价化合物,化学键类型是共价键,
所以答案是:共价键.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】在CH3COONa溶液里,加入下列物质使水解平衡向左移动,并且pH变大的是( )
A.加入适量纯CH3COOH
B.加入少量NaCl固体
C.加入少量NaOH固体
D.加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表达正确的是( )
A.二氧化碳的比例模型 ![]()
B.原子核内有10个中子的原子: ![]() C
C
C.Fe3+的最外层电子排布式为3s23p63d5
D.Cu基态的外围电子排布图: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在量热器中将50mL,0.50molL﹣1CH3COOH溶液与50mL、0.55molL﹣1NaOH溶液混合,温度从25.16℃升高到27.46℃.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J0C﹣1 , C=4.18Jg﹣10C﹣1 , 溶液的密度为1gcm﹣3 . 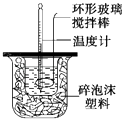
(1)试求CH3COOH的“中和热”.
(2)请你分析(1)中测得的实验值偏差可能是什么原因造成的? .
(3)若HNO3 (aq)+NaOH(aq)=NaNO3(aq)+H2O(l);△H=﹣57.3KJmol﹣1;
现有①稀H2SO4与Ba(OH)2(aq) ②浓H2SO4与Ba(OH)2(aq)
③HNO3与Ba(OH)2(aq)反应生成1molH2O(l) 的反应热分别为△H1、△H2、△H3 ,
则△H1、△H2、△H3三者由小到大的关系为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( ) 
A.温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大
B.温度越高,Mg(ClO3)2饱和溶液的质量分数越大
C.350K时,Mg(ClO3)2饱和溶液的物质的量浓度为 ![]()
D.350 K时,Mg(ClO3)2饱和溶液的质量分数为 ![]() ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.含有0.1NA个CO32﹣的Na2CO3固体的质量为10.6g
C.标准状况下,aL的氧气和氮气的混合物含有的原子数为 ![]() ×NA
×NA
D.标准状况下,11.2LCCl4含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶甲和乙的混合液,已知甲和乙的某些性质如表所示:
物质 | 熔点/℃ | 沸点/℃ | 密度/(g·cm3) | 溶解性 |
甲 | 68 | 115 | 0.93 | 易溶于乙 |
乙 | 84 | 77 | 0.90 | 易溶于甲 |
据此,将甲和乙相互分离的最佳方法是
A.过滤法 B.蒸发法
C.萃取法 D.蒸馏法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同.回答下列问题:
(1)X、Y和Z的元素符号分别为、、 .
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有、 .
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的物质的电子式为此化合物在酸性条件下与高锰酸钾反应的离子方程式为;此化合物还可将碱性工业废水中的CN﹣氧化为碳酸盐和氨,相应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com