
【题目】表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | 1.8×10-10 | 2.0×10-12 | 1.8×10-5 | 3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式H2O+CO32-+Cl2=HCO3-+Cl-+HClO
C.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COO-):c(CH3COOH)=9:5,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3,CrO42-先沉淀
【答案】C
【解析】
A. 根据题意得出酸性强弱:CH3COOH>HClO,相同浓度CH3COONa和NaClO的混合液中,根据越弱越水解,ClO-水解程度大于CH3COO-水解,因此各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故A错误;
B. 根据题意得出酸性强弱:H2CO3>HClO>HCO3-,因此碳酸钠溶液中滴加少量氯水的离子方程式H2O+2CO32-+Cl2 = 2HCO3-+Cl-+ ClO-,故B错误;
C. 向0.1mol·L1CH3COOH溶液中滴加NaOH溶液至c(CH3COO-):c(CH3COOH)=9:5,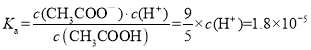 ,解得
,解得![]() ,此时溶液pH=5,故C正确;
,此时溶液pH=5,故C正确;
D. 向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中,根据Ksp(AgCl)=1.8×1010= c(Ag+)c(Cl-),Cl-开始沉淀需要c(Ag+) =1.8×1010÷(1×10-3)= 1.8×107mol·L1,Ksp(Ag2CrO4)=2.0×1012= c2(Ag+)c(CrO42),CrO42开始沉淀需要c(Ag+) =![]() =4.47×105mol·L1>1.8×107mol·L1,因此滴加1×10-3mol·L-1的AgNO3,Cl-先沉淀,故D错误;
=4.47×105mol·L1>1.8×107mol·L1,因此滴加1×10-3mol·L-1的AgNO3,Cl-先沉淀,故D错误;
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】镁、铝、铁合金投入300mL ![]() 溶液中,金属恰好溶解,分别转化成
溶液中,金属恰好溶解,分别转化成![]() 和
和![]() ;还原产物为NO,在标准状况下体积为6.72L。在反应后的溶液中加入300mL某浓度的NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g。下列有关推断正确的是( )
;还原产物为NO,在标准状况下体积为6.72L。在反应后的溶液中加入300mL某浓度的NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g。下列有关推断正确的是( )
A.参加反应的![]() 的物质的量为0.9molB.NaOH的物质的量浓度为6
的物质的量为0.9molB.NaOH的物质的量浓度为6![]()
C.参加反应的金属的质量为11.9gD.![]() 的物质的量浓度为3
的物质的量浓度为3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3 和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯(ClO2)气体,该反 应的化学方程式为 2 KClO3 + 4HCl(浓) = 2 KCl + 2ClO2↑ + Cl2↑ + 2H2O。
(1)该反应的氧化产物是_____(填化学式)。
(2)在反应中浓盐酸表现出来的性质是_____(填字母)。
A.只有还原性 B.只有氧化性 C.还原性和酸性 D.氧化性和酸性
(3)若该反应产生 2.24 L(标准状况)ClO2,则转移电子的物质的量为_____。
(4)Cl2、H2O2、ClO2(还原产物为 Cl-)、O3(1 mol O3 转化为 1 mol O2 和 1 mol H2O)等物质常 被用作消毒剂。等物质的量的上述物质消毒效率最高的是_____(填序号)。
A.Cl2 B.H2O2 C.ClO2 D.O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )

A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2的导电能力之和大于HA的
C.b点的混合溶液pH大于7
D.c点的混合溶液中,c(Na+)>c(OH)>c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子的浓度变化如图所示(第一次平衡时c(I-)=2×10-3mol·L-1,c(Pb2+)=1×10-3mol·L-1),下列说法不正确的是

A.常温下,PbI2的Ksp=4×10-9
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度减小,Pb2+浓度不变
C.T时刻可能向溶液中加入了KI固体,Ksp不变
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将由等物质量的铝、镁组成的混合物分成四等份,分别加入足量的①3mol/LNaOH溶液,②2mol/L稀硝酸(还原产物仅有NO),③18mol/LH2SO4,④1mol/LH2SO4产生气体物质的量由小到大的顺序为( )
A.①②③④B.②③①④C.④②①③D.③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下Cu能与Fe3+发生反应:Cu+2Fe3+=Cu2++2Fe2+现将铜粉与二氧化二铁的混合物22.4g加入到1mol/L的H2SO4溶液中进行反应。
(1)若固体恰好溶解,消耗硫酸的体积为V,则V的取值范围是_______。
(2)若硫酸溶液过量,反应后溶液的体积为1L,测得此溶液中Fe2+的浓度为0.1mol/L,则混合物中含铜_______g或_______g(只需写出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:
![]()
(1)写出实验室制取![]() 的离子方程式______________,
的离子方程式______________,![]() 表示阿伏伽德罗常数,若有
表示阿伏伽德罗常数,若有![]() 的
的![]() 被氧化,则转移的电子总数为______________;将足量的MnO2投入到含2mol HCl的浓盐酸中,充分加热,可生成Cl2______________(填>0.5mol;=0.5mol;<0.5mol)
被氧化,则转移的电子总数为______________;将足量的MnO2投入到含2mol HCl的浓盐酸中,充分加热,可生成Cl2______________(填>0.5mol;=0.5mol;<0.5mol)
(2)现有以下3种试剂:A.饱和食盐水B.浓硫酸C.![]() 溶液,请在以上试剂中选择并回答填空:Y溶液应选用___________ (填写序号):X试剂的作用_________。
溶液,请在以上试剂中选择并回答填空:Y溶液应选用___________ (填写序号):X试剂的作用_________。
(3)某兴趣小组的同学为探究和比较![]() 和氯水的漂白性,设计了如下的实验装置。
和氯水的漂白性,设计了如下的实验装置。
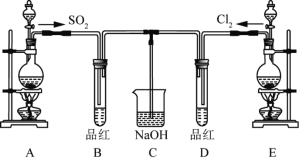
①实验室用装置![]() 制备
制备![]() 。某同学在实验时发现打开
。某同学在实验时发现打开![]() 的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_______;
的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_______;
②反应开始一段时间后,观察到![]() 、
、![]() 两试管中的品红溶液都出现褪色的现象,取下后两试管外观无区别,请你帮助设计实验加以鉴别,你的操作是____________。
两试管中的品红溶液都出现褪色的现象,取下后两试管外观无区别,请你帮助设计实验加以鉴别,你的操作是____________。
③若左右气体流速相同,写出C烧杯中的化学方程式____________。(写总方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求写出相应的化学方程式。
(1)乙二酸与乙二醇通过缩聚反应生成聚酯: ________。
(2)对苯二甲酸与乙二醇合成涤纶: ________________。
(3)苯酚与甲醛合成线状酚醛树脂: ___________。
(4)1,3-丁二烯合成顺丁橡胶: __________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com