
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| A、-218kJ?mol-1 |
| B、-109kJ?mol-1 |
| C、+218kJ?mol-1 |
| D、+109kJ?mol-1 |
| ①×3-(②×3+③×2) |
| 6 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| ①×3-(②×3+③×2) |
| 6 |
| 24.8×3-(-15.73×3)-640.4×2 |
| 6 |


科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、三氯化铝溶液跟过量氨水反应:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| C、向含1mol KAl(SO4)2的溶液中逐滴Ba(OH)2至生成沉淀的质量最大时的离子方程式:2Al3++3SO42-+3Ba2++6OH-=2 Al(OH)3↓+3BaSO4↓ |
| D、向澄清石灰水中加入几滴NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,隔板I、Ⅱ均可自由移动,保持温度相同,
如图所示,隔板I、Ⅱ均可自由移动,保持温度相同,查看答案和解析>>
科目:高中化学 来源: 题型:
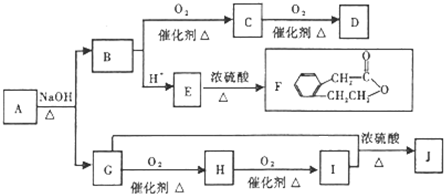
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
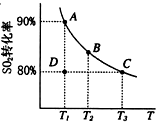
| 催化剂 |
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
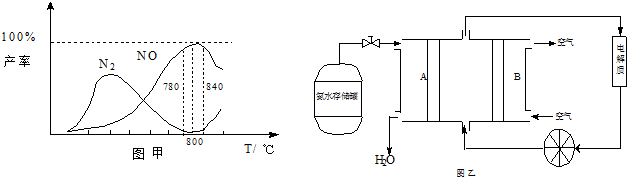
查看答案和解析>>
科目:高中化学 来源: 题型:
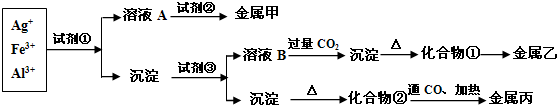
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com