
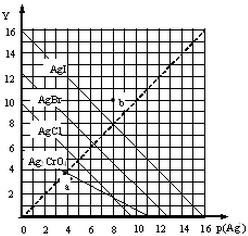
 卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )
卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )| A. | 该温度下Ag2CrO4的Ksp约为1×10-22 | |
| B. | a点可表示AgCl的饱和溶液 | |
| C. | b点c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
分析 A、结合图象,依据Ksp(Ag2CrO4)=c2(Ag+)×c(CrO42-)计算即可;
B、依据a点计算出AgCl的Qc与Ksp(AgCl)比较,若Qc>Ksp(AgCl),则此时溶液为饱和溶液,据此解答即可;
C、依据图象分别得出此时c(Ag+)和c(I-)即可判断;
D、依据图象得出此温度下,AgCl的溶解度大于AgBr的溶解度,据此判断浓度即可.
解答 解:A、依据图象得出此温度下,当Y=0,即Y=-lgc(CrO42-)=0,c(CrO42-)=1时,p(Ag+)═-lgc(Ag+)=12,故Ksp(Ag2CrO4)=c2(Ag+)×c(CrO42-)=(1×10-12)2×1=10-24,故A错误;
B、由图象得出此温度下,饱和AgCl溶液的Ksp(AgCl)=10-10,a点c(Ag+)=10-4:c(Cl-)=10-4,故AgCl的Qc=c(Cl-)×c(Ag+)=10-8>10-10,此点为氯化银的饱和溶液,故B正确;
C、由图象得出b点c(Ag+)=10-8,c(I-)=10-10,两者不相同,故C错误;
D、由于此温度下,AgCl的溶解度大于AgBr的溶解度,故溶液中c(Cl-)>c(Br-),故D错误,
故选B.
点评 本题主要考查的是难溶电解质的溶解平衡图象以及分析图象的能力,充分理解图象并从图象中得出解题所需要的信息是关键,锻炼了同学们识图、信息整合的能力.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:选择题
| A. | H2(g)+F2(g)=2HF(g)△H=-Q1 kJ•mol-1 H2(g)+Cl2(g)=2HCl(g)△H=-Q2 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-Q1 kJ•mol-1 2H2(g)+O2(g)=2H2O(g)△H=-Q2 kJ•mol-1 | |
| C. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-Q1 kJ•mol-1 NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-Q2 kJ•mol-1 | |
| D. | S(s)+O2(g)=SO2(g)△H=-Q1 kJ•mol-1 S(g)+O2(g)=SO2(g)△H=-Q2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Na+向负极移动 | |
| B. | 放电时,正极上发生的反应为xS+2Na++2e-=Na2Sx | |
| C. | 充电时,阳极上发生的反应为2Na-2e-=2Na+ | |
| D. | 放电时,每有0.4mol电子转移,则有9.2gNa和6.4g硫参加反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一名同学把4.48L(一折算成标准状况下)某有机物蒸汽在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓硫酸的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(一折算成标准状况下)某有机物蒸汽在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓硫酸的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物的结构如下所示,有关该物质的说法错误的是( )
某有机物的结构如下所示,有关该物质的说法错误的是( )| A. | 该物质的分子式为C8H8O3 | |
| B. | 该物质分子中的8个碳原子都在同一个平面上 | |
| C. | 该物质既可以发生酯化反应又可以发生缩聚反应 | |
| D. | 1mol该物质可以与2mol金属Na反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4mol/L | B. | 1.4mol/L | C. | 1.2mol/L | D. | 0.7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的浓度相等 | B. | X、Y、Z在容器中共存 | ||
| C. | 正、逆反应速率都等于零 | D. | X、Y、Z的浓度均不再改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com