
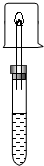
 在盛有少量无水乙醇的试管中,加入一小块新切的、擦干表面煤油的金属钠,迅速用配有导管的单孔塞塞住试管口,用一小试管收集并验纯气体后,点燃,并把干燥的小烧杯罩在火焰上,片刻,迅速倒转烧杯,向烧杯中加入少量澄清石灰水.观察现象,完成下表.
在盛有少量无水乙醇的试管中,加入一小块新切的、擦干表面煤油的金属钠,迅速用配有导管的单孔塞塞住试管口,用一小试管收集并验纯气体后,点燃,并把干燥的小烧杯罩在火焰上,片刻,迅速倒转烧杯,向烧杯中加入少量澄清石灰水.观察现象,完成下表.| 乙醇与钠反应的现象 | 气体燃烧的现象 | 结论 |
| ①Na沉到试管底部 ②反应有气泡产生 | 气体燃烧时火焰呈蓝色, 小烧杯内壁有水珠, 澄清石灰水不变浑浊. | 气体产物为H2 |
分析 乙醇与钠的反应现象:根据钠与乙醇密度的相等大小推断现象;根据生成物的状态推断现象;根据化学反应的反应热推断现象;
气体燃烧的现象:根据氢气燃烧的火焰颜色、燃烧后生成物的性质分析;
检验产物:通过气体燃烧的现象判断生成物.
解答 解:乙醇与钠的反应现象:钠的密度大于乙醇的密度,所以将钠加入乙醇中,钠会沉到试管底部;钠和乙醇反应生成气体,所以可观察到有气泡产生;该反应是一个放热反应,所以溶液温度升高.
气体燃烧的现象:氢气燃烧时火焰的颜色是蓝色,该气体燃烧时火焰呈蓝色;小烧杯内壁有水珠,向烧杯中加入少量澄清石灰水.石灰水不浑浊,说明没有二氧化碳,据此得出产物是氢气,故答案为:
| 乙醇与钠反应的现象 | 气体燃烧的现象 | 检验产物 |
| ①Na沉到试管底部 ②反应有气泡产生 | 蓝色 有水珠(或有水雾) 不变浑浊 | H2 |
点评 本题考查了乙醇与钠的反应,通过此题乙醇和钠的反应现象与水和钠的反应现象作比较,可得出乙醇中的羟基不如水中的羟基活泼.


科目:高中化学 来源: 题型:选择题
| A. | C6H5COOH | B. | C6H13COOH | C. | C7H15COOH | D. | C6H5CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,粗铜板作阴极 | |
| B. | 冶金工业中,常用铝热反应原理冶炼钒、铬、锰等金属 | |
| C. | 工业上采取把氯气通入烧碱溶液的方法生产漂白粉 | |
| D. | 玻璃、水泥、高温结构陶瓷均为传统硅酸盐工业产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④①③⑥③ | B. | ④③①⑥⑤③ | C. | ①③②⑥③ | D. | ④①③⑤⑥③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com