
【题目】CuSO4是一种重要的化工原料,有关制备途径及性质如图所示。下列说法错误的是
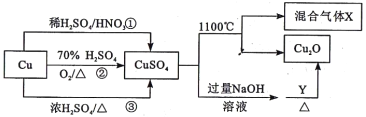
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量: ①=②<③
C. 硫酸铜在1100℃分解的方程式为:2CuSO4![]() Cu2O+SO2↑+SO3↑+O2↑
Cu2O+SO2↑+SO3↑+O2↑
D. 当Y为葡萄糖时,葡萄糖发生还原反应
【答案】D
【解析】A、途径①涉及反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,NO3-由硝酸提供,H+由硝酸和硫酸共同提供,所以若硝酸为2mol,则硫酸为(8-2)÷2=3mol,所以混酸中H2SO4与HNO3物质的量之比最好为3:2,故A正确。B、途径②涉及反应为2Cu+2H2SO4+O2=2CuSO4+2H2O;途径③涉及反应Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;若生成1mol硫酸铜,途径①消耗1mol硫酸,途径②消耗1mol硫酸,途经③消耗2mol硫酸,所以三个途径中,生成等量的硫酸铜,参加反应的硫酸的物质的量: ①=②<③,故B正确。C、据图可知,CuSO4在1100℃分解产生Cu2O和混合气体X,Cu2O为化合价降低的产物,则混合气体X中一定有化合价升高的产物,则一定含有O2,根据原子守恒,CuSO4在1100℃分解的方程式可能为2CuSO4
CuSO4+SO2↑+2H2O;若生成1mol硫酸铜,途径①消耗1mol硫酸,途径②消耗1mol硫酸,途经③消耗2mol硫酸,所以三个途径中,生成等量的硫酸铜,参加反应的硫酸的物质的量: ①=②<③,故B正确。C、据图可知,CuSO4在1100℃分解产生Cu2O和混合气体X,Cu2O为化合价降低的产物,则混合气体X中一定有化合价升高的产物,则一定含有O2,根据原子守恒,CuSO4在1100℃分解的方程式可能为2CuSO4![]() Cu2O+SO2↑+SO3↑+O2↑,故B正确;D、硫酸铜与过量的NaOH反应生成氢氧化铜,葡萄糖中含有醛基,能与新制氢氧化铜在NaOH过量的条件下反应生成Cu2O和葡萄糖酸钠,体现了葡萄糖的还原性,葡萄糖发生氧化反应,故D错误。故选D。
Cu2O+SO2↑+SO3↑+O2↑,故B正确;D、硫酸铜与过量的NaOH反应生成氢氧化铜,葡萄糖中含有醛基,能与新制氢氧化铜在NaOH过量的条件下反应生成Cu2O和葡萄糖酸钠,体现了葡萄糖的还原性,葡萄糖发生氧化反应,故D错误。故选D。


科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B. NaHCO3在水溶液中的电离方程式:NaHCO3= Na++H++CO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日我国在天安门广场举行了建国70周年国庆大阅兵。下列环节与化学无关的是( )
A.研制出战机编队使用的无毒、环保的彩烟剂
B.制造广泛用于坦克、飞机和服装等的隐形涂料
C.释放7万羽和平鸽象征着中国人民爱好和平
D.用氦气代替氢气填充彩色气球更加安全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
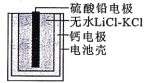
A. Ca为正极 B. 放电过程中,Li+向负极移动
C. 每转移0.2mol电子,理论上生成20.7gPb D. 电池工作一段时间后,正极质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室干馏煤的装置图,结合下图回答问题。

(1)指出图中仪器名称:a__________;b__________;c__________;d__________。
(2)装置c的作用是____________________________________,d中的液体有________和________。有机物可以通过________的方法使其中的重要成分分离出来。
(3)e处点燃的气体是________,火焰的颜色是________色。
(4)下列叙述错误的是________。
A.煤发生了化学变化
B.d中液体显碱性
C.d中液体不分层
D.e处的气体可以还原氧化铜,也可以使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的位置关系如图:
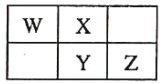
I.若Y元素原子的最外层电子数是电子层数的2倍。
(1)Z在周期表中的位置是___。
(2)写出铜和W的最高价氧化物的水化物的稀溶液反应的离子方程式:__________。
(3)Z最高价氧化物的水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28mol电子发生转移时,共产生9mol气体,写出该反应的化学方程式:____________。
II.若X和Y的核外电子数之和为22。
(4)X的气态氢化物的电子式为______,将该氢化物通入硝酸溶液中,恰好反应时所得溶液中离子浓度大小的顺序为____________。
(5)W的单质与Z的最高价氧化物的水化物的浓溶液反应,当电子转移0.4mol时,产生气体的体积是_________(标准状况)。
(6)下列能比较Z元素与氯元素非金属性强弱的是_________。
A.氯气通入硫化钠溶液中,溶液变浑浊
B.盐酸是强酸,氢硫酸是弱酸
C.氯化氢比硫化氢稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是
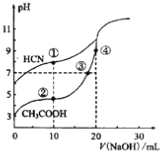
A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C. 点④所示溶液液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟电化学反应的装置图,有关叙述正确的是
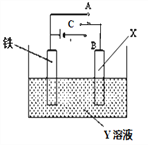
A. X为碳棒,Y为NaCl溶液,开关C置于A处,铁棒表面 产生气体
B. X为铜棒,Y为CuSO4溶液,开关C置于B处,铁棒质量将减小,溶液中Cu2+浓度也减小
C. X为碳棒,Y为NaCl溶液,开关C置于B处,电子由负极流到铁片,再由铁片通过溶液流到碳棒,最后流回正极
D. X为锌片,Y为NaCl溶液,开关C置于A处,铁氧化速率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,下列叙述错误的是( )

A. 根据右图该反应的平衡常数表达式为![]()
B. 若在第7分钟时增加D的物质的量,A的物质的量变化情况符合a曲线
C. 若在第5分钟时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大
D. 从反应开始到第一次达到平衡时,A物质的平均反应速率为0. 067mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com