
| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:A>C | |
| C. | B和D最高价氧化物对应水化物相互不反应 | |
| D. | 单质B常温下能溶于浓硝酸 |
分析 A、C的原子序数的差为8,说明A、C同主族,结合三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.令B的最外层电子数为x,则x+2x+2x=15,解得x=3,再根据短周期元素A、B、C、D,原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素,以此解答该题.
解答 解:A、C的原子序数的差为8,说明A、C同主族,结合三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.令B的最外层电子数为x,则x+2x+2x=15,解得x=3,再根据短周期元素A、B、C,原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素.
A、由于B、C、D同周期,原子序数依次增大,同一周期,从左到右半径在减小,原子半径B>C>D,D为氯元素,A为氧元素,原子半径为D>A,故原子半径为B>C>D>A,故A错误;
B、A、C同主族,自上而下金属性增强,非金属性减弱,所以非金属性A>C,故B正确;
C、B和D最高价氧化物对应水化物分别为氢氧化铝和高氯酸,二者发生中和反应,故C错误;
D、B为铝元素,常温下铝在浓硝酸钝化,不能溶解,故D错误.
故选B.
点评 本题考查学生利用原子的结构和位置来推断元素,为高考常见题型,侧重于学生的分析能力的考查,明确半径、金属性非金属性、最高价氧化物对应水化物的酸性的比较规律,题目难度不大.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏产物主要成分是碳氢化合物 | |
| B. | 工业上可通过石油的裂解获得大量乙烯 | |
| C. | 重油经过裂化可以得到汽油 | |
| D. | 煤中含有苯、甲苯,可用分馏的方法将它们分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此溶液中Na2SO3已部分氧化? | |
| B. | 加入Ba(NO3)2溶液生成的沉淀一定含BaSO4? | |
| C. | 加HCl后的不溶沉淀一定为BaSO4? | |
| D. | 此样品未被氧化? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L苯中含有的分子数目为NA | |
| B. | 25℃、101 kPa时,20 g SO3中含有的原子数目为NA | |
| C. | 1 L 1 mol•L-1 MgCl2溶液中含有的氯离子数目为NA | |
| D. | 16.8 g Fe与足量水蒸气反应,转移的电子数目为0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧的生成物是过氧化钠 | |
| B. | 与水反应时都能生成碱和氢气 | |
| C. | 熔沸点随原子序数增加而升高 | |
| D. | 碱金属单质还原性随原子电子层数的增加而增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
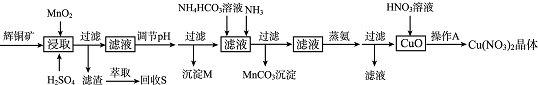
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H6 | B. | CH3CHO | C. | CH3COOH | D. | CH2=CH-COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com