
°æƒø°øE «“ª÷÷÷Œ¡∆–ƒ—™πк≤≤°µƒ“©ŒÔ£¨À¸µƒ∫œ≥…¬∑œþ»Áœ¬£∫ 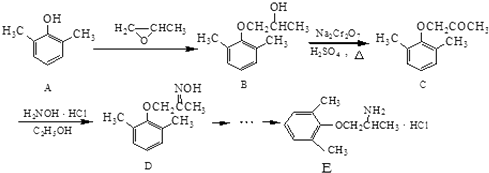
£®1£©C∑÷◊”÷–∫¨—ıπŸƒÐÕ≈µƒ√˚≥∆Œ™ £Æ
£®2£©”…B°˙Cµƒ∑¥”¶¿ý–ÕŒ™ £Æ
£®3£©”…A÷∆±∏Bµƒπ˝≥Ã÷–”–…Ÿ¡ø∏±≤˙ŒÔF£¨À¸”ÎBª•Œ™Õ¨∑÷“Ïππã¨FµƒΩ·ππºÚ ΩŒ™ £Æ
£®4£©–¥≥ˆÕ¨ ±¬˙◊„œ¬¡–Ãıº˛µƒDµƒ“ª÷÷Õ¨∑÷“ÏππõƒΩ·ππºÚ Ω£∫ £Æ ¢Ÿ Ù”⁄¶¡©Å∞±ª˘À·£ª
¢⁄ «±Ωµƒ—Ð…˙ŒÔ£¨«“±Ωª∑…œµƒ“ª¬»¥˙ŒÔ÷ª”–¡Ω÷÷£ª
¢€∑÷◊”÷–∫¨”–¡Ω∏ˆ ÷–‘ú‘≠◊”£Æ
£®5£©“—÷™““œ©‘⁄¥þªØº¡◊˜”√”Ηı∆¯∑¥”¶ø…“‘…˙≥…ª∑—ı““ÕÈ£® ![]() £©£Æ –¥≥ˆ“‘¡⁄º◊ª˘±Ω∑” £®
£©£Æ –¥≥ˆ“‘¡⁄º◊ª˘±Ω∑” £® 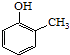 £©∫Õ““¥ºŒ™‘≠¡œ÷∆±∏
£©∫Õ““¥ºŒ™‘≠¡œ÷∆±∏ 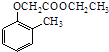 µƒ∫œ≥…¬∑œþ¡˜≥ÃÕº£®ŒÞª˙ ‘º¡»Œ”√£©£Æ
µƒ∫œ≥…¬∑œþ¡˜≥ÃÕº£®ŒÞª˙ ‘º¡»Œ”√£©£Æ
∫œ≥…¬∑œþ¡˜≥ÃÕº æ¿˝»Áœ¬£∫H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH£Æ
CH3CH2OH£Æ
°æ¥∞∏°ø
£®1£©√—º¸°¢Ù ª˘
£®2£©—ıªØ∑¥”¶
£®3£©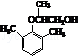
£®4£©![]()
£®5£©Ω‚£∫ 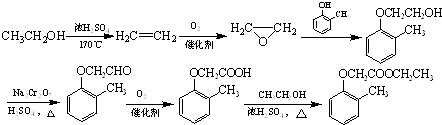
°æΩ‚Œˆ°øΩ‚£∫£®1£©”…Ω·ππºÚ Ωø…÷™C∫¨”–√—º¸°¢Ù ª˘£¨À˘“‘¥∞∏ «£∫√—º¸°¢Ù ª˘£ª£®2£©B°˙Cµƒ∑¥”¶÷–©ÅOH…˙≥…C=O£¨Œ™—ıªØ∑¥”¶£¨À˘“‘¥∞∏ «£∫—ıªØ∑¥”¶£ª3£© ![]() ÷–∫¨”–2∏ˆC©ÅOº¸£¨”ÎA∑¢…˙∑¥”¶ ±ø…”–¡Ω÷÷≤ªÕ¨µƒ∂œ¡—∑Ω Ω£¨…˙≥…µƒ¡Ì“ª÷÷”–ª˙ŒÔµƒΩ·ππºÚ ΩŒ™£∫
÷–∫¨”–2∏ˆC©ÅOº¸£¨”ÎA∑¢…˙∑¥”¶ ±ø…”–¡Ω÷÷≤ªÕ¨µƒ∂œ¡—∑Ω Ω£¨…˙≥…µƒ¡Ì“ª÷÷”–ª˙ŒÔµƒΩ·ππºÚ ΩŒ™£∫ 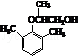 £¨ À˘“‘¥∞∏ «£∫
£¨ À˘“‘¥∞∏ «£∫ 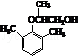 £ª£®4£©Dµƒ“ª÷÷Õ¨∑÷“ÏππÃÂ÷–£∫¢Ÿ Ù”⁄¶¡©Å∞±ª˘À·£ª¢⁄ «±Ωµƒ—Ð…˙ŒÔ£¨«“±Ωª∑…œµƒ“ª¬»¥˙ŒÔ÷ª”–¡Ω÷÷£¨”¶Œª”⁄∂‘ŒªŒª÷√£ª¢€∑÷◊”÷–∫¨”–¡Ω∏ˆº◊ª˘£¨‘Ú¬˙◊„Ãıº˛µƒ”–ª˙ŒÔµƒÕ¨∑÷“ÏππÃÂŒ™£∫
£ª£®4£©Dµƒ“ª÷÷Õ¨∑÷“ÏππÃÂ÷–£∫¢Ÿ Ù”⁄¶¡©Å∞±ª˘À·£ª¢⁄ «±Ωµƒ—Ð…˙ŒÔ£¨«“±Ωª∑…œµƒ“ª¬»¥˙ŒÔ÷ª”–¡Ω÷÷£¨”¶Œª”⁄∂‘ŒªŒª÷√£ª¢€∑÷◊”÷–∫¨”–¡Ω∏ˆº◊ª˘£¨‘Ú¬˙◊„Ãıº˛µƒ”–ª˙ŒÔµƒÕ¨∑÷“ÏππÃÂŒ™£∫ ![]() £¨
£¨
À˘“‘¥∞∏ «£∫ ![]() £ª£®5£©÷∆±∏
£ª£®5£©÷∆±∏  £¨”¶œ»÷∆±∏““À·∫Õ
£¨”¶œ»÷∆±∏““À·∫Õ 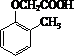 £¨““¥º—ıªØø……˙≥…““À·£¨““¥ºœ˚»•ø……˙≥…““œ©£¨““œ©—ıªØø……˙≥…
£¨““¥º—ıªØø……˙≥…““À·£¨““¥ºœ˚»•ø……˙≥…““œ©£¨““œ©—ıªØø……˙≥… ![]() £¨”Î
£¨”Î 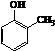 ∑¥”¶…˙≥…
∑¥”¶…˙≥…  £¨Ω¯∂¯—ıªØø……˙≥…
£¨Ω¯∂¯—ıªØø……˙≥…  £¨‘Ú∑¥”¶µƒ¡˜≥ÃŒ™
£¨‘Ú∑¥”¶µƒ¡˜≥ÃŒ™  £¨
£¨
À˘“‘¥∞∏ «£∫  £Æ
£Æ


 Ω∞ÊøŒÃ√øŒ ±—µ¡∑œµ¡–¥∞∏
Ω∞ÊøŒÃ√øŒ ±—µ¡∑œµ¡–¥∞∏ µ•‘™»´ƒÐ¡∑øºæÌœµ¡–¥∞∏
µ•‘™»´ƒÐ¡∑øºæÌœµ¡–¥∞∏ –¬ª∆∏‘±¯∑®√ÐæÌœµ¡–¥∞∏
–¬ª∆∏‘±¯∑®√ÐæÌœµ¡–¥∞∏
| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø—ıªØªπ‘≠∑¥”¶‘⁄…˙≤˙°¢…˙ªÓ÷–”¶”√π„∑∫£Æœ¬¡–∑¥”¶≤ª Ù”⁄—ıªØªπ‘≠∑¥”¶µƒ «£® £©
A.ƒæÃø»º…’£∫C+O2 ![]() CO2
CO2
B.Ï—…’ ت“ Ø£∫CaCO3 ![]() ?CaO+CO2°¸
?CaO+CO2°¸
C.Ã˙µƒ“±¡∂£∫Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
D.µÁΩ‚ÀÆ£∫2H2O ![]() 2 H2°¸+O2°¸
2 H2°¸+O2°¸
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø»ÁÕºÀ˘ æ «∑÷¿ÎªÏ∫œŒÔ ±≥£”√µƒ“«∆˜£¨ªÿ¥œ¬¡–Œ £∫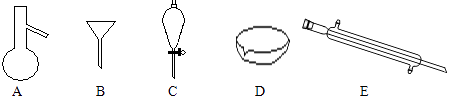
£®1£©–¥≥ˆ“«∆˜C°¢Eµƒ√˚≥∆°¢
£®2£©∑÷¿Î“‘œ¬ªÏ∫œŒÔ”¶∏√÷˜“™—°”√…œ ˆ ≤√¥“«∆˜£ø£®ÃÓ◊÷ƒ∏∑˚∫≈£©
¢ŸNaClπÃÃÂ∫Õƒý…≥£∫¢⁄ª®…˙”Õ∫ÕÀÆ£∫
£®3£©»ÙœÚC◊∞÷√÷–º”»Îµ‚ÀÆ∫Õ◊„¡øCCl4 £¨ ≥‰∑÷’Òµ¥∫Ûæ≤÷√£¨π€≤ÏµΩœ÷œÛ «£∫Cƒ⁄“∫ÃÂ∑÷¡Ω≤„£¨…œ≤„“∫ÃÂ…´£¨œ¬≤„“∫ÃÂ…´£Æ
£®4£©µ‚µ•÷ ∫Չµ•÷ ”–œý¿ýÀ∆µƒ–‘÷ £¨∂ºø…“‘”√”–ª˙»Ðº¡ðÕ»°ÀƻГ∫÷–µƒµ•÷ £¨»Ù¿˚”√C“«∆˜Ã·»°‰ÂÀÆ÷–µƒ‰Âµ•÷ £¨œ¬¡–”–ª˙»Ðº¡÷–≤ªƒÐ—°”√µƒ «£∫
A.∆˚”Õ
B.CCl4
C.æ∆æ´
D.¥◊À·£Æ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø–ø‰Â“∫¡˜µÁ≥ÿ «“ª÷÷–¬–ÕµÁªØ—ߥ¢ƒÐ◊∞÷√£®»ÁÕºÀ˘ 棩£¨µÁΩ‚“∫Œ™‰ÂªØ–øÀƻГ∫£¨µÁΩ‚÷ »Ð“∫‘⁄µÁΩ‚÷ ¥¢πÞ∫ÕµÁ≥ÿº‰≤ª∂œ—≠ª∑£Æœ¬¡–Àµ∑®≤ª’˝»∑µƒ «£® £© 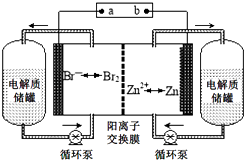
A.—Ù¿Î◊”Ωªªªƒ§ø…◊Ë÷πBr2”ÎZn÷±Ω”∑¢…˙∑¥”¶
B.∑≈µÁ ±∏∫º´µƒµÁº´∑¥”¶ ΩŒ™Zn©Å2e©Å=Zn2+
C.≥‰µÁ ±µÁº´a¡¨Ω”µÁ‘¥µƒ∏∫º´
D.∑≈µÁ ±◊Û≤ýµÁΩ‚÷ ¥¢πÞ÷–µƒ¿Î◊”◊Ð≈®∂»‘ˆ¥Û
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø◊€∫œ¿˚”√CO2∂‘ª∑æ≥±£ª§º∞ƒÐ‘¥ø™∑¢“‚“Â÷ÿ¥Û£Æ 
£®1£©Li2O°¢Na2O°¢MgOæ˘ƒÐŒ¸ ’CO2 £Æ »Áπ˚—∞’“Œ¸ ’CO2µƒ∆‰À˚ŒÔ÷ £¨œ¬¡–Ω®“È∫œ¿Ìµƒ « £Æ a£Æø…‘⁄ºÓ–‘—ıªØŒÔ÷–—∞’“
b£Æø…‘⁄¢ÒA°¢¢ÚA◊‘™Àÿ–Œ≥…µƒ—ıªØŒÔ÷–—∞’“
c£Æø…‘⁄æþ”–«ø—ıªØ–‘µƒŒÔ÷ ÷–—∞’“
£®2£©¿˚”√∑¥”¶Aø…Ω´ Õ∑≈µƒCO2◊™ªØŒ™æþ”–𧓵¿˚”√º€÷µµƒ≤˙∆∑£Æ∑¥”¶A£∫CO2+H2O ![]() CO+H2+O2“—÷™£∫»ÁÕº1À˘ 棨‘Ú∑¥”¶Aµƒ»»ªØ—ß∑Ω≥Ã Ω « £Æ
CO+H2+O2“—÷™£∫»ÁÕº1À˘ 棨‘Ú∑¥”¶Aµƒ»»ªØ—ß∑Ω≥Ã Ω « £Æ
£®3£©∏þŒ¬µÁΩ‚ºº ıƒÐ∏þ–ß µœ÷£®3£©÷–∑¥”¶A£¨π§◊˜‘≠¿Ì æ“‚Õº»ÁÕº2£∫ ¢ŸµÁº´b∑¢…˙£®ÃÓ°∞—ıªØ°±ªÚ°∞ªπ‘≠°±£©∑¥”¶£Æ
¢⁄CO2‘⁄µÁº´a∑≈µÁµƒ∑¥”¶ Ω « £Æ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¡◊À·≈˛»©Àÿ «œ∏∞˚÷ÿ“™◊È≥…≤ø∑÷£¨ø… ”Œ™¡◊À·£®∑÷◊”÷–”–3∏ˆÙ«ª˘£©–Œ≥…µƒı•£¨∆‰Ω·ππºÚ Ω»ÁÕº£¨œ¬¡–Àµ∑®¥ÌŒÛµƒ «£® £© 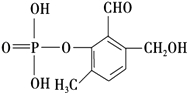
A.ƒÐ”ÎΩ Ùƒ∆∑¥”¶
B.ƒÐ π Ø»Ô ‘“∫±‰∫Ï
C.ƒÐ∑¢…˙“¯æµ∑¥”¶
D.1mol∏√ı•”ÎNaOH»Ð“∫∑¥”¶£¨◊Ó∂ýœ˚∫ƒ3molNaOH
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡– Ù”⁄ŒÔ¿Ì±‰ªØµƒ «
A.√∫µƒ∏…¡ÛB.Ã˛µƒ¡—ªØC.ø…»º±˘»º…’D. ؔյƒ∑÷¡Û
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“—÷™»»ªØ—ß∑Ω≥Ã Ω£∫ H2O£®g£©=H2£®g£©+ ![]() O2£®g£©£ª°˜H=+241.8kJ/mol
O2£®g£©£ª°˜H=+241.8kJ/mol
H2£®g£©+ ![]() O2£®g£©=H2O£®l£©£ª°˜H=©Å285.8kJ/mol
O2£®g£©=H2O£®l£©£ª°˜H=©Å285.8kJ/mol
µ±1g“∫èÀƱ‰Œ™ÀÆ’Ù∆¯ ±£¨∆‰»»¡ø±‰ªØ «£® £©
A.Œ¸»»88 kJ
B.Œ¸»»44 kJ
C.∑≈»»44 kJ
D.Œ¸»»2.44 kJ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øƒ≥»Ð“∫ø…ƒÐ∫¨”–Na+°¢K+°¢Mg2+°¢Cu2+µ»—Ù¿Î◊”º∞MnO©Å4°¢SiO2©Å4°¢AlO©Å2°¢CO2©Å3°¢HCO©Å3°¢SO2©Å4°¢Cl©Åµ»“ı¿Î◊”£¨“—÷™£∫¢Ÿ∏√»Ð“∫≥ ŒÞ…´¢⁄æ≠≤‚∂®»Ð“∫µƒpH=12¢€»°…Ÿ¡ø»Ð“∫£¨º”»Îœ°—ŒÀ·[100mL°¢2molL©Å1]Ω¯––À·ªØ£¨”–∞◊…´≥¡µÌ…˙≥…£¨ªπµ√µΩ“ª÷÷ŒÞ…´ŒÞŒ∂µƒ∆¯Ã£¨∏√∆¯Ã π≥Œ«Â ت“ÀÆ£®◊„¡ø£©±‰ªÎ◊«£Æ∂‘À·ªØ∫Ûµƒ»Ð“∫π˝¬À£¨µ√µΩ¬À“∫º◊£Æ
£®1£©”…¢Ÿ°¢¢⁄°¢¢€ø…≈–∂œ£∫‘≠»Ð“∫÷–“ª∂®≤ª¥Ê‘⁄µƒ¿Î◊” « £¨ “ª∂®¥Ê‘⁄µƒ¿Î◊” « £Æ
£®2£©Ω´¬À“∫º◊∑÷≥…¡Ωµ»∑𣨓ª∑ð÷–÷µŒº”»Î∞±ÀÆ£¨◊Ó÷’”–∞◊…´Ω∫◊¥≥¡µÌ£¨Àµ√˜‘≠»Ð“∫÷–“ª∂®”–£®ÃÓ¿Î◊”∑˚∫≈£©£¨∏’ø™ ºº”»Î∞±ÀÆ ±£¨√ª”–≥¡µÌ≤˙…˙£¨‘≠“Ú « £Æ £®”√¿Î◊”∑Ω≥Ã Ω±Ì æ£©£ª¡Ì“ª∑ð÷–º”»Î◊„¡øµƒBa£®NO3£©2»Ð“∫£¨”–∞◊…´≥¡µÌ…˙≥…£¨Àµ√˜‘≠»Ð“∫÷–“ª∂®”–£®ÃÓ¿Î◊”∑˚∫≈£©£¨π˝¬Àµ√µΩ¬À“∫““£Æ
£®3£©Õ˘¬À“∫““÷–º”»Î◊„¡øµƒAgNO3»Ð“∫£¨π˝¬À°¢œ¥µ”°¢∏…‘Ôµ√πÃÃÂ26.5g£¨‘Ú‘≠»Ð“∫÷– «∑Ò”–Cl©Å£®ÃÓ°∞ «°±ªÚ°∞∑Ò°±£©£Æ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
∞Ÿ∂»÷¬–≈ - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com