
NA代表阿伏加德罗常数的值,下列说法正确的是
A. 2.8g铁与0.05mol Cl2充分反应,转移0.15NA电子
B. 27g Al与足量NaOH溶液反应生成 33.6L H2
C. 14g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有原子的数目为3NA
D. 0.1mol Na2O2与足量二氧化碳反应转移0.2NA个电子
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源:2017届陕西省宝鸡市高三教学质量检测(一)理综化学试卷(解析版) 题型:选择题
某溶液中含有大量的K+、Cl-及X与Y两种离子,现向该溶液加入W试剂,根据实验现象得到的关于X、Y离子的推断能成立的是
W试剂 | 实验现象 | X、Y离子的推测 | |
A | KI—淀粉溶液 | 溶液变蓝 | Fe3+、SO42- |
B | 用pH试纸检测 | pH=7(常温) | CH3COO-、Na+ |
C | 硝酸酸化的AgNO3溶液 | 白色沉淀 | CO32-、NH4+ |
D | 过量NaOH溶液 | 无明显现象 | Al3+、Mg2+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:填空题
运用所学知识,回答下列问题。
I、向硫酸铜溶液中逐滴加入KI溶液至恰好反应完全,观察到产生白色沉淀CuI,蓝色溶液变为棕色。该反应的离子方程式为__________;取一定量上述反应后的上层棕色清液于一支试管中,加入一定量的苯,振荡,此时观察到的现象是________。
II、工业上用铝土矿(主要成分为Al2O3,只含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
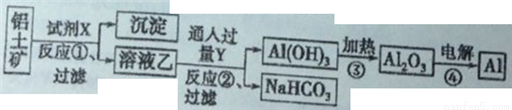
回答下列问题:
(1)上述反应是否都是氧化还原反应_________(填“是”或“否”);写出反应①的化学方程式_____。
(2)反应①后过滤的沉淀为_______,简述确定此物质中金属元素及其价态的操作过程_______。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列各组中的两种物质作用时,反应条件或反应物的用量改变时,对生成物没有影响的是
A. Na与O2 B. Na2O2与CO2 C. Ca(OH)2与NaHCO3 D. NaOH与CO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. SO2能使酸性KMnO4溶液、溴水、品红溶液褪色,且原理相同
B. 不能用澄清石灰水鉴别SO2和CO2
C. 硫粉在过量的纯氧中燃烧可以生成SO3
D. 少量SO2通过浓的CaCl2溶液能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:推断题
在下列物质转化中,A是一种酸式盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
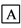
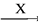
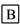
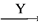
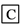
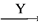

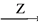
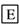
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。请回答:
(1)A是________, Z是________。
(2)当X是强酸时,写出B生成C的化学方程式:___________________。
(3)当X是强碱时,E是________,写出E和铜反应生成C的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
A. Na和O2 B. NaOH和CO2
C. Na2O2和CO2 D. 木炭(C)和O2
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:简答题
震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
资料:氰化钠化学式NaCN(N元素-3价),白色结晶颗粒,剧毒,易溶于水
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式________________。
(2)某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过下图装置制备Na2S2O3。
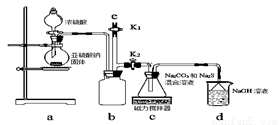
①a装置中盛浓硫酸的仪器名称是_______________;
b装置的作用是________________。
②c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有___________________。
③实验结束后,在e处最好连接盛_________(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,目的是__________________
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
① 废水中氰化钠的最高排放标准为0.50 mg/L。
② Ag++2CN- = [ Ag (CN)2]-, Ag++I- = AgI↓, AgI呈黄色,且CN-优先与Ag+反应。
实验如下:
取25.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50 mL。
④滴定终点的判断方法是____________________
⑤处理后的废水中氰化钠的含量为__________mg/L,_______(选填“能”、“不能”)排放
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上学期期末考试化学试卷(解析版) 题型:填空题
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指
导,合成氨反应的平衡常数K值和温度的关系如下:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是__________。(填序号)
a.增大压强有利于合成氨
b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500ºC左右
d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____________________________。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl?),则一水合氨的电离平衡常数Kb=______________。(用ab表示)
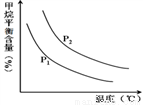
(4)原料气H2可通过反应 CH4(g) + H2O (g) CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的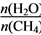 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
①图中,两条曲线表示压强的关系是:P1_______________P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__________。(填“增大”,“减小”减小,“不变”不变)
(5)原料气H2还可通过反应CO(g) + H2O(g)  CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,该温度下反应的平衡常数K值为______________。
②保持温度仍为T ℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是______________(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1 : 16 : 6 : 6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com