解答:解:X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,则三种气体单质为氢气、氮气、氧气.三种气体单质相互反应生成H
2O、NH
3、NO,一个B分子中含有的Z元素的原子个数比一个C分子中少一个,则B为H
2O,C为NH
3,Z为氢元素.由关系图可知:Z单质与X单质反应生成B(H
2O),故X为氧元素;Z单质与Y单质反应生成C(NH
3),故Y为氮元素;所以A为NO.W的单质在常温常压下为固体,并且W元素是形成化合物种类最多的元素,则W为碳元素.
即X为氧元素,Y为氮元素,Z为氢元素,W为碳元素;A为NO,B为H
2O,C为NH
3.
(1)X为氧元素,原子核外有8个电子,有2个电子层,最外层电子数为6各电子,处于周期表中第2周期第ⅥA族.故答案为:第2周期第ⅥA族;
(2)C为NH
3,A为NO,氨气在催化剂并加热的条件下生成一氧化氮与水,反应方程式为4NH
3+5O
2 4NO+6H
2O,
故答案为:4NH
3+5O
2 4NO+6H
2O;
(3)常温下,将C(NH
3)通入元素Y(N)的最高价氧化物的水化物的水溶液HNO
3中,Y为氮元素,最高价氧化物的水化物为HNO
3,氨气与硝酸反应生成硝酸铵,得到pH=5的溶液,反应后的溶液存在的平衡体系有:NH
4++H
2O?NH
3?H
2O+H
+;H
2O?OH
-+H
+;硝酸铵属于强酸弱碱盐,铵根离子水解,溶液呈酸性,所以 c(NO
3-)>c(NH
4+),c(H
+)>c(OH
-);
故答案为:NH
4++H
2O?NH
3?H
2O+H
+;H
2O?OH
-+H
+; c(NO
3-)>c(NH
4+)>c(H
+)>c(OH
-);
(4)实验室里为制取C(NH
3),常在C的浓溶液中加入生石灰.氧化钙溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧化钙吸水,促使氨放出;生成的氢氧化钙电离出的OH
-增大了氨水中OH
-浓度,促使氨水电离平衡左移,导致氨气放出.
故答案为:氧化钙溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧化钙吸水,促使氨放出;生成的氢氧化钙电离出的OH
-增大了氨水中OH
-浓度,促使氨水电离平衡左移,导致氨气放出;
(5)Y的单质(N
2)与Z的单质(H
2)生成C(NH
3)的反应是可逆反应,△H<0,反应为:N
2+3H
2 2NH
3;,△H<0;
a、化学平衡的标志是正逆反应速率相同,故a正确;
b、将等物质的量的Y(N
2)、Z(H
2)的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应,设起始量都为1mol,则
N
2+3H
2 2NH
3起始量 1 1 0
变化量 x 3x 2x
平衡量 1-x 1-3x 2x
所以氮气所占体积分数为物质的量的百分数=
×100%=50%,所以Y(N
2)的单质的体积分数始终为50%,故b正确;
c、达到化学平衡时,Y(N
2)的单质的体积分数始终为50%,H
2和NH
3共占50%,所以两种单质在混合气体中的物质的量之比不为1:1,故c错误;
d、达到化学平衡的过程中,气体质量不变,气体物质的量减小,所以混合气体平均相对分子质量增大,故d错误;
e、到化学平衡后,再升高温度,反应是放热反应,平衡逆向进行,C(NH
3)的体积分数减小.故e错误;
综上所述ab正确;
故答案为:ab.
(6)X为氧元素,Z为氢元素,W为碳元素,三种元素形成化合物C
2H
6O,其蒸汽通过灼热的氧化铜,黑色的氧化铜会逐渐变红,则该化合物为乙醇CH
3CH
2OH,该反应的化学方程式为
CH
3CH
2OH+CuO
CH
2CHO+Cu+H
2O,故答案为:CH
3CH
2OH+CuO
CH
2CHO+Cu+H
2O;

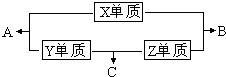 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:

 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化: