
海洋植物如海带、海藻中含有丰富的碘元素,其主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
(1)指出提取碘的过程中有关的实验操作名称:① ,③ ;
(2)操作③中所用的有机试剂可以是 (只填一种),简述选择其理由 。
(3)操作过程③可以分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞; |
| C.检验分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; |
(1)①过滤 ③萃取
(2)四氯化碳或苯;不与水反应、与水互不相溶
(3)(a)CBDAHGEF (b)保持上下气压一致,使溶液顺利流下。
解析试题分析:(1)操作①由悬浊液得到固体和溶液,所以是过滤;操作③中碘难溶于水易溶于有机溶剂,用有机溶剂萃取碘水中的碘单质。(2)选择萃取剂注意三点:①与原来的溶剂互不相溶。②与原溶液不发生反应。③便于分离和提纯。(3)操作过程③包括萃取和分液两步,在分液漏斗中进行。分液漏斗使用时注意几点:①查漏②装液③振荡使其充分萃取(振荡时要放气) ④静置分层 ⑤分液(下层从下口先放出,上层从上口倒出。放液体时先打开上端活塞,否则液体不能顺利流下。)
考点:考查物质的分离和提纯。


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:填空题
为提纯含NaCl和Na2SO4两种杂质的NaNO3溶液,且逐一分离出杂质,某同学设计了如下的实验流程: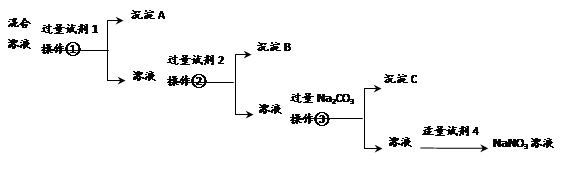
(1)操作①②③的名称都是________(填操作名称)。
(2)写出试剂的名称:试剂1___________;试剂2_____________。
(3)操作③之前加入Na2CO3的目的是________________________。
(4)加入试剂4后,发生反应的离子方程式为_________________。
控制试剂4的加入量“适量”的方法是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: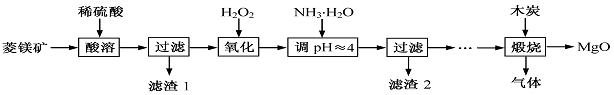 (1)MgCO3与稀硫酸反应的离子方程式为 。
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:2MgSO4+C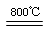 2MgO+2SO2↑+CO2↑、MgSO4+C
2MgO+2SO2↑+CO2↑、MgSO4+C MgO+SO2↑+CO↑、 MgSO4+3C
MgO+SO2↑+CO↑、 MgSO4+3C MgO+S↑+3CO↑。
MgO+S↑+3CO↑。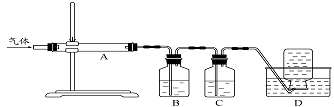
利用上图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下: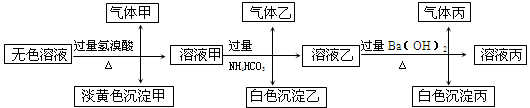
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O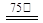 ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O 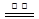 ZnFe2O4 + 2CO2↑+4CO↑+6H2O ……………(b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O ……………(b)
(1)上述制备原理中属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ、(NH4)2Fe(SO4)2·6H2O,Ⅱ、ZnSO4·7H2O及Ⅲ、(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n(Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,然后升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤干净的依据是 _________________。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有: 和 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息利用实验可提供的试剂制取纯净的ZnSO4溶液。实验中可选用的试剂如下: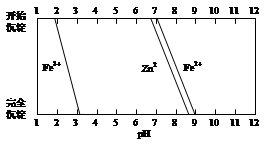
a.30%H2O2;
b.新制氯水;
c.1.0 mol·L-1NaOH溶液;
d.3 mol·L-1稀硫酸;
e.纯ZnO粉末;
f.纯锌粉。
实验步骤依次为:①将锌片完全溶于稍过量的3 mol·L-1稀硫酸,加入 (选填字母,下同);②加入 ;③加热到60℃左右并不断搅拌;④过滤得ZnSO4溶液。其中步骤③加热的主要目的有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题。
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用软锰矿(主要成分为MnO2)制备高锰酸钾的工艺流程如图所示: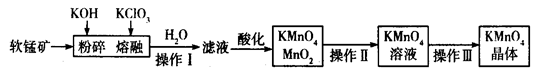
(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。下列 酸能用于酸化高锰酸钾溶液的是____________(填序号)。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.氢硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钒的用途十分广泛,有金属“维生素”之称。某工厂为了从含有杂质的VOSO4样品中回收得到催化剂V2O5,设计流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式)。NH4VO3在焙烧前要洗涤2-3次,该步操作方法为 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
步骤②中萃取时必须加入适量碱,其原因是 。
步骤③中X试剂为 。
(3)⑤的离子方程式为 。
(4)该工艺流程中,可以循环利用的物质有 和 。
(5)若取VOSO4样品wg,测得消耗a mol·L—1氯酸钾溶液VmL(氯酸钾还原产物为氯化钾),则1kg样品理论上可制得的V2O5质量是 g(用含w、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含 量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com