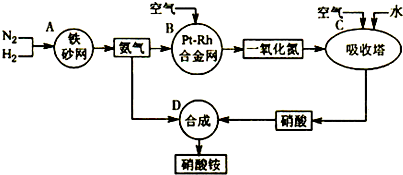
分析:根据二氧化氮和水的化学反应方程式:3NO2+H2O=2HNO3+NO,化合价变化的元素中只有N,化合价升高元素所在的反应物是还原剂,所在产物是氧化产物,化合价降低元素所在的反应物是氧化剂,所正在产物是还原产物.
解答:解:二氧化氮和水的化学反应方程式为3NO2+H2O=2HNO3+NO.
A、在反应应中,化合价变化的元素中只有N,故A错误;
B、二氧化氮中氮元素的化合价既升高了,也降低了,所以二氧化氮既是氧化剂又是还原剂,故B错误;
C、二氧化氮中氮元素的化合价既升高了,也降低了,所以二氧化氮既是氧化剂又是还原剂,故C错误;
D、二氧化氮中氮元素的化合价既升高了,也降低了,所以二氧化氮既是氧化剂又是还原剂,故D正确.
故选D.
点评:本题考查学生氧化还原反应中氧化剂和还原剂的概念,可以根据所学知识来回答,难度不大.