
【题目】现有以下物质:①NaHCO3晶体②液态SO3③HF④盐酸⑤蔗糖⑥铜⑦KOH固体⑧氨水。请回答下列问题;
(1)属于非电解质的是________________,
(2)属于电解质的_______________,
(3)属于电解质的依次写出其在水中的电离方程式:______________
【答案】(1)②⑤ (2)①③⑦
(3)NaHCO3=Na++HCO3-,HCO3-![]() H++CO32-;HF
H++CO32-;HF![]() H++F-;KOH=K++OH-
H++F-;KOH=K++OH-
【解析】
试题分析:(1)在水溶液中和熔融状态下均不能导电的化合物为非电解质,故为非电解质的为②⑤;
(2)在水溶液中或熔融状态下能导电的化合物为电解质,故为电解质的是①③⑦;
(3)碳酸氢钠属于强电解质,溶液中完全电离,碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3-,HCO3-还能继续电离,电离方程式为:HCO3-![]() H++CO32-;氢氟酸为弱酸,电离离子方程式为:HF
H++CO32-;氢氟酸为弱酸,电离离子方程式为:HF![]() H++F-;
H++F-;
KOH为强电解质,在溶液中能完全电离,电离方程式为:KOH=K++OH-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,以下说法不正确的是
A. 集中处理废旧电池,以防止重金属污染环境
B. 海产品中加入大量甲醛以延长保鲜期
C. 食用蔬菜水果可以补充人体所需维生素
D. 使用加碘盐,可预防因缺碘引起的甲状腺肿大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①钠比水轻;②钠的熔点较低;③钠与水反应时要放出热量;④钠与水反应后溶液呈碱性.某学生将一小块金属钠投入滴有酚酞试液的水中,该实验能证明上述四点性质中的( )
A.①④
B.①②④
C.①③④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列基态原子的电子排布式正确的是( )
A. O 1s22s23s24s2
B. K 1s22s23p63s23p64s2
C. N 1s22s22p3
D. Cl 1s22s22p62s33p6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然碱样品的组成可能为aNa2CO3bNaHCO3cH2O(a、b、c为正整数)。为确定其组成,某小组进行如下实验:
(1)定性实验
①取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。___________(填“能”或“不能”)说明样品中含结晶水,试简述理由 ;
②请设计一个简单方案,确认样品中含有CO32- 。
(2)定量分析
该同学设计了如下图所示装置,测定天然碱的化学组成。
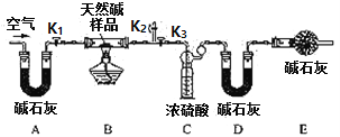
实验步骤:
①组装好实验装置后,首先进行的操作是 ;A处碱石灰的作用是;E处碱石灰的作用是 。
②称7.3g样品,放入硬质玻璃管中;称量C装置质量为87.6g,D装置为74.7g。
③打开活塞K1、K2,关闭K3,通入空气数分钟。
④关闭活塞Kl、K2,打开K3,点燃酒精灯至不再产生气体为止。
⑤打开活塞Kl,鼓入空气数分钟,然后称得C装置质量为88.5g;D装置质量为75.8g,通入空气的目的是 。
⑥如果a=1,则该天然碱的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:
C(s)+H2O(g)![]() CO(g)+H2(g)ΔH=+131.4kJ/mol
CO(g)+H2(g)ΔH=+131.4kJ/mol
(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密度增大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为______________________。
(2)关于上述反应在化学平衡状态时的描述正确的是 。
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:
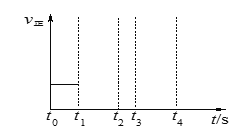
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,水的摩尔蒸发焓为44.0 kJ/mol,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为 。当甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。
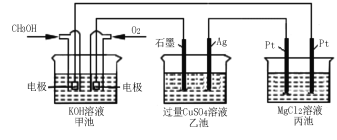
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com