
ij��Һ��ֻ���±������еļ��֣�������ˮ�ĵ���������ˮ�⣩���Ҹ����ӵ����ʵ���Ũ�Ⱦ�Ϊ0.1mol/L��
������ | K+ NH4+ Fe2+ Mg2+ Al3+ Cu2+ |
������ | OH- Cl- Al02- CO32- SiO32- SO42- |
ijͬѧ����������ʵ�飨��Ҫʱ�ɼ��ȣ�

����˵����ȷ����
A��ԭ��Һ��ֻ����NH4+ Fe2+ Cl- SO42-
B���ɳ���A�ƶ�ԭ��Һ��һ������SO42-
C����ҺA�п��ܺ���K+ Al3+ Cl-
D������B��һ������Mg(OH)2

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�߰��и�����ѧ�ڵڶ��ζο���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͼ��ʾװ�ý�������ʵ�飺��������Һ������У�Ԥ���������ʵ���������

ѡ�� | �������� | �������� | Ԥ����е����� |
A�� | ϡ���� | ̼�������������ƵĻ����Һ | ������������ |
B�� | Ũ���� | ��ɰֽ��ĥ�������� | ��������ɫ���� |
C�� | �Ȼ�����Һ | Ũ����������Һ | ����������ɫ���� |
D�� | ������Һ | �������������Һ | ��Һ����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��㶫ʡӢ���и�����ѧ�ڵڶ����¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������͢����ȷ�����������ϵ����
ѡ�� | ������ | ������ |
A | Na2S��ǿ��ԭ�� | ���ڳ�ȥ��ˮ�е�Cu2+��Hg2+ |
B | CaCO | CaCl2��Һ��ͨ��CO2������ɫ���� |
C | ŨH2SO4��ǿ������ | ŨH2SO4�����ڸ���SO2 |
D | Zn���л�ԭ�Ժ͵����� | ������п�̸ɵ�صĸ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ӱ�ʡ�����и�����ѧ�������Ի�ѧ�Ծ��������棩 ���ͣ������
��14�֣��Թ�ҵ��ˮ��������ˮ���д����Ƿ�ֹˮ����Ⱦ������ˮ�ʵ���Ҫ��ʩ֮һ��
��ش��������⣺
��1�����Ṥ�������Է�ˮ���飨As��Ԫ�أ���Ҫ������H3As03��ʽ���ڣ��������ߣ�Ϊ��������ŷţ�ij�������û�ѧ���������������ˮ��
����֪���ǵ���ͬ��Ԫ�أ��ȵ�ԭ�Ӷ�2�����Ӳ㣬����Ԫ�����ڱ���λ��Ϊ ��AsH3���ȶ��Ա�NH3���ȶ��� ���ǿ����������������
�ڹ�ҵ�ϲ�������ͨ�������ƣ�ȥ����ˮ�е��飬�������ܵ������飬�÷�Ӧ�����ӷ���ʽΪ ��
��2������8��1 2����������������Σ��Ʒ�ֿⷢ����ը�¹ʣ������軯����ը�������й©��CNһ�о綾��й¶����ȾˮԴ�Ϳ�������Ҫ������
�ٰ�֪HCNΪһԪ���ᣬ��NaCN��Һ��pH 7���>����=����<������
�ڴ�����CNһ��ˮ�ķ���֮һ��������������£�CN-������������HC03һ��ͬʱ����NH3���÷�Ӧ�����ӷ���ʽΪ
��3��������������������������Һ��ͬʱ�õ������ԭ������ͼ��ʾ��ͼ�С�HA������ʾ������ӣ�A--��ʾ��������ӣ���
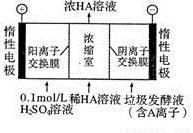
�����ĵ缫��ӦʽΪ ����Ũ�����еõ�Ũ�����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ������ѧ�ڵ�һ����ϲ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������������ʽ��ȷ����
A����ӦMnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O��1molMnO2������ת��2mol����
B��NaHSO4������״̬�µĵ��뷽��ʽΪ��NaHSO4=Na����HSO4-
C��������ˮ����(CaCO3��BaSO4��)�����������
D����Ҫͨ��ſɽ��е��У���⡢��Ӿ�����롢��ơ��绯��ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�°���У��������ѧ�ڵڶ���ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��14C��ǵ�һ��C60������������ض������»����DNA���ư��̲����ķ�ֳ�������й�14C��������ȷ����
A����12C60��̼ԭ�ӻ�ѧ���ʲ�ͬ B����15N������������ͬ
C����12C60��Ϊͬ�������� D����12C��13C��Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶���ѧ�����б���ѧ�Ծ��������棩 ���ͣ�ѡ����
��500mLϡ�����м���һ�����������ۣ�������ȫ�ܽ�ų�NO����5.6L����״������ͬʱ��Һ��������9.3g�������ж���ȷ����
A��ԭ��Һ��Ͷ���������ʵ�����0.25mol
B��ԭ��Һ�е�HNO3Ũ����2.0mol/L
C����Ӧ�����Һ�л������ܽ�9.6gͭ
D����Ӧ�����Һ��c��Fe2+����c��Fe3+��=1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��㶫ʡ��Զ�и߶���ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
��1������ˮ�����������¶ȣ�һ�����Լӿ�þ��ˮ�ķ�Ӧ����
��2�����������Ũ�ȣ�һ�����Լӿ�п�����ᷴӦ��ȡ����������
��3�����ڷ�ӦCaCO3��s�� 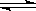 CaO��s�� + CO2��g��������CaCO3���������Լӿ�����Ӧ���ʣ�������CaO��CO2��Ũ�ȣ�����Լӿ��淴Ӧ����
CaO��s�� + CO2��g��������CaCO3���������Լӿ�����Ӧ���ʣ�������CaO��CO2��Ũ�ȣ�����Լӿ��淴Ӧ����
��4�����ڷ�Ӧ3H2��g�� + N2��g�� 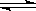 2NH3��g�������ܱ������н��У��̶���������ֳ��뺤��������������ѹǿ������ѧ��Ӧ���ʼӿ�
2NH3��g�������ܱ������н��У��̶���������ֳ��뺤��������������ѹǿ������ѧ��Ӧ���ʼӿ�
��5�����ڷ�Ӧ3H2��g�� + N2��g�� 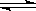 2NH3��g����ʹ���ʺϴ��������淴Ӧ����ͬ�ȳ̶ȼӿ�
2NH3��g����ʹ���ʺϴ��������淴Ӧ����ͬ�ȳ̶ȼӿ�
A����1����2�� B����1����2����3��
C����1����2����3����4�� D����5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������ʡ�绯�и�����ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
��10�֣���ˮ����þ��MgSO4•7H2O����ӡȾ����ֽ��ҽҩ�ȹ�ҵ�϶��й㷺��Ӧ�ã����û�����������ɰ�ķ�������þ�����ȡ��ˮ����þ����þ�����Ҫ�ɷ���MgCO3���������������ʣ�MgO��SiO2��Fe2O3��FeO��CaO��Al2O3��MnO�ȣ���
��1 ����������������������ʽ��ȫ����ʱ��Һ��pH
������ | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Mn��OH��2 | Mg��OH��2 |
pHֵ | 5��2 | 3��2 | 9��7 | 10��4 | 11��2 |
��2 �����ε��ܽ�ȣ���λΪg/100gˮ��
�¶�/�� | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0��19 | 0��21 | 0��21 | 0��20 | 0��19 |
MgSO4•7H2O | 30��9 | 35��5 | 40��8 | 45��6 | / |
��þ����ȡ��ˮ����þ�Ĺ����������£�
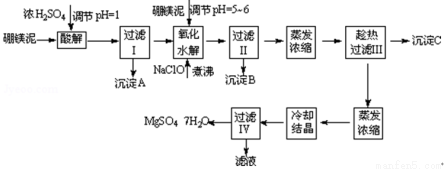
������������ͼ���ο�����pH���ݺ��ܽ�����ݣ��Իش��������⣺
��1������I����Һ�м�����þ�࣬������Һ��pH=5��6���ټ���NaClO��Һ������У�����Һ�е�Mn2+������MnO2����Ӧ�����ӷ�Ӧ����ʽΪ ��������е���ҪĿ���� ��
��2������B�г�MnO2��SiO2����� ���ѧʽ�������ʣ�
��3��������ˢ�����Һ���Ƿ���Fe3+��ʵ�鷽���� ��
��4������C�Ļ�ѧʽ�� �����ˢ�����ȹ��˵������� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com