
下图是部分短周期元素原子(用字母表示)最外层电
子数与原子序数的关系图。下列说法正确的是 ( )
A.该图体现出原子核外电子层呈现周期性变化
B.原子半径:W>R>X
C.W的氢化物与R的氢化物水溶液的酸性比较,前者强于后者, 可证明非金属性:R>W
D.R、Z形成的化合物中可能含有共价键

 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
“科学与技术”模块(10分)
电石浆是氯碱工业中的一种废弃物,其大致组成如 下表所示:
下表所示:
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其它不溶于酸的物质 |
| 质量分数(%) | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23~26 |
用电石浆可生产无水 ,某化工厂设计了以下工艺流程:
,某化工厂设计了以下工艺流程:
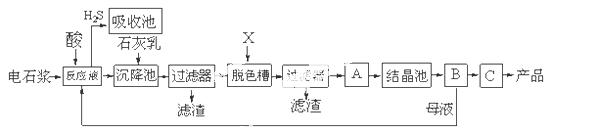
已知氯化钙晶体的化学式是:CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
(1)反应器中 加入的酸应选用 。
加入的酸应选用 。
(2)脱色槽中应加入的物质X是 ‚ ;设备A的作用是 ƒ ;设备B的名称为 ④ ;设备C的作用是 ⑤ 。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是 ⑥ 。
A.水 B.浓硫酸 C.石灰乳 D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是 ⑦ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是
 A.混合酸中HNO3物质的量浓度2 mol·L-1
A.混合酸中HNO3物质的量浓度2 mol·L-1
B.原混合酸中H2SO4物质的量为0.4 mol
C.OA段产生的是NO,AB段的反应为
Fe+2Fe3+=3Fe2+,BC段产生氢气
D.第二份溶液中最终溶质为FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )

A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中[H+]与[OH-]乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
周期表中有些元素有“对角线相似”现象,如Li、
Mg;Be、Al;B、Si等两两性质相似。若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电极电解,结
果得到金属锂和一种无色无味的气体。下列说法正确的是 ( )
A.LiOH易溶于水 B.电解前LiCl在加热时已发生水解
C.无色气体为电解生成的H2 D.Li和水反应要比Na和水剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,错误的是 ( )
A.只含非极性键的纯净物一定是单质
B.只含极性键的纯净物一定是化合物
C.只含离子键的纯净物一定存在金属元素
D.纯净物中一定存在化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是 ( )
①CH4(g)+2O2(g)= ==CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1
==CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1
②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
③CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
④2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
A.仅有② B.仅有②④
C.仅有②③④ D.全部符合要求
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com