
 ,它在一定条件下可能发生的反应是( )
,它在一定条件下可能发生的反应是( )| A. | ①③④⑤⑥⑦ | B. | ②③④⑤⑥ | C. | ①③⑤⑥⑦ | D. | ①③④⑤⑦ |
分析 该物质中含有醇羟基、苯环、羧基和醛基,具有醇、苯、羧酸和醛的性质,能发生酯化反应、取代反应、氧化反应、加成反应、缩聚反应、银镜反应等,以此解答该题.
解答 ①有机物含有醛基,则它能和氢气发生加成反应,生成醇羟基,故①可能发生;
②有机物中不含有卤代烃,也不含有酯基,故②不可能发生;
③有机物含有羧基能和醇羟基发生酯化反应,含有的醇羟基也能羧酸发生酯化反应,故③可能发生;
④有机物含有醇羟基结构,醇羟基能被氧化成醛基,该有机物中含有醛基,醛基能被氧化成羧酸,故④可能发生;
⑤有机物含有羧基,具有酸性,能和碱发生中和反应,故⑤可能发生;
⑥有机物中含有醇羟基,且醇羟基相邻的碳上含有氢原子,故能发生消去反应,故⑥可能发生;
⑦有机反应中,去氧或加氢的反应应为还原反应,该有机物中含有醛基,可以加氢生成醇,故⑦可能发生.
故选A.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,侧重考查醇、醛、羧酸和苯环性质,注意能发生消去反应的醇结构特点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | B的物质的量浓度减小 | D. | C的体积分数降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
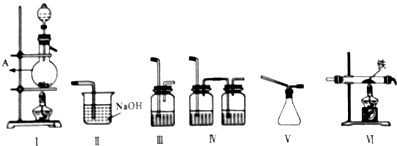
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 范德华力、范德华力、氢键 | B. | 范德华力、范德华力、共价键 | ||
| C. | 共价键、共价键、共价键 | D. | 范德华力、氢键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
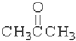 ③
③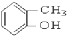 ④
④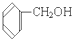 ⑤
⑤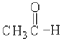 ⑥
⑥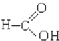
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH平衡时浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | a1 | a2 | a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
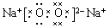
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com