


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合物中氢氧化铁的质量分数可能为70% |
| B、所需0.5 mol?L-1 H2SO4 溶液的体积为600mL |
| C、原混合物中硫化亚铁的质量分数可能为25% |
| D、反应中转移电子物质的量为0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

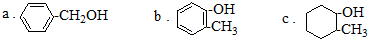
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置,实验时,将分液漏斗的活塞打开,从U形管的长管口注入稀硝酸,一直到U形管的短管口单孔塞下沿且液面上不再留有气泡为止.关闭活塞,并用酒精灯在U形管短管下微热.当铜丝上有气泡产生时,立即撤去酒精灯.
为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置,实验时,将分液漏斗的活塞打开,从U形管的长管口注入稀硝酸,一直到U形管的短管口单孔塞下沿且液面上不再留有气泡为止.关闭活塞,并用酒精灯在U形管短管下微热.当铜丝上有气泡产生时,立即撤去酒精灯.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用铂丝蘸取某溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰颜色为紫色,说明原溶液中只含有钾离子 |
| B、SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
| C、实验室配制950毫升0.2摩尔每升的CuSO4溶液时,需称取胆矾的质量为50克 |
| D、制备Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,在加热的同时不断搅拌,直到得到红褐色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com