
| A. | Fe→Fe3+ | B. | HCl→Cl2 | C. | MnO4-→Mn2+ | D. | NH3→NO |
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠溶液可使酚酞溶液变红的原因:CH3COO-+H2O?CH3COOH+OH- | |
| B. | 加热蒸发氯化铝溶液,最终可得到无水氯化铝固体 | |
| C. | 加热蒸发硫酸铜溶液可得到五水硫酸铜晶体 | |
| D. | 5mL1mol/L醋酸钠溶液与5mL1mol/L盐酸混合液中:c(Cl-)=c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
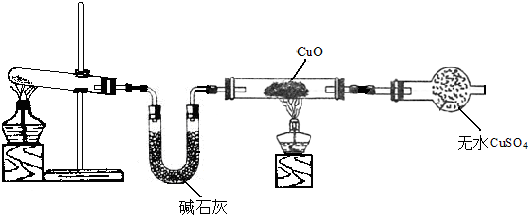
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 三氯化磷($\stackrel{+3}{P}$Cl3)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质.PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料.
三氯化磷($\stackrel{+3}{P}$Cl3)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质.PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
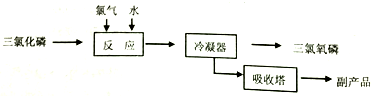
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2、N2O4 | B. | 石墨、氧气 | C. | H2SO4、HClO | D. | NaCl、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中加BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42- | |
| B. | 向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32- | |
| C. | 向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明原溶液一定有Fe2+ | |
| D. | 向某无色溶液中加浓NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则说明原溶液中一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业制得的纯碱中往往含有氯化钠杂质,为测定含NaC1杂质的样品中Na2CO3的质量分数,.他们采用如图所示装置,把一定质量的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积.
工业制得的纯碱中往往含有氯化钠杂质,为测定含NaC1杂质的样品中Na2CO3的质量分数,.他们采用如图所示装置,把一定质量的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 22.4L氯气和氢气的物质的量都是1mol | |
| B. | 1mol氯气和氢气的体积都是22.4L | |
| C. | 标准状况下22.4L氯气的物质的量为1mol | |
| D. | 标准状况下1mol氢气的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含有Fe2+、Cu2+、Clˉ,不含有Fe3+ | B. | c(Fe2+):c(Cu2+)=1:1 | ||
| C. | c(Fe3+):c(Fe2+)=1:3 | D. | c(Clˉ)=0.9mol/L,c(Fe3+)=0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com