
 .
.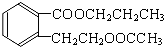 +2 NaOH$\stackrel{△}{→}$
+2 NaOH$\stackrel{△}{→}$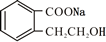 +CH3COONa+CH3CH2CH2OH.
+CH3COONa+CH3CH2CH2OH.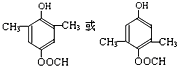 .
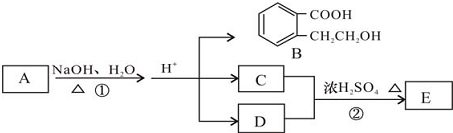
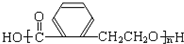
.分析 E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,则碳原子数目为$\frac{102×58.8%}{12}$=5,H原子数目为$\frac{102×9.8%}{1}$=10,氧原子数目=$\frac{102-12×5-10}{16}$=2,则E的分子式为C5H10O2,E由C和D反应生成,C能和碳酸氢钠反应,则C为羧酸,D为醇,二者共含5个C原子,并且C和D的相对分子质量相等,则C为CH3COOH、D为丙醇,E无支链,D为CH3CH2CH2OH,E为CH3COOCH2CH2CH3.A是由B与乙酸、丙醇发生酯化反应后生成的产物,A结构简式为: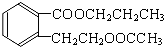 .
.
解答 解:E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,则碳原子数目为$\frac{102×58.8%}{12}$=5,H原子数目为$\frac{102×9.8%}{1}$=10,氧原子数目=$\frac{102-12×5-10}{16}$=2,则E的分子式为C5H10O2,E由C和D反应生成,C能和碳酸氢钠反应,则C为羧酸,D为醇,二者共含5个C原子,并且C和D的相对分子质量相等,则C为CH3COOH、D为丙醇,E无支链,D为CH3CH2CH2OH,E为CH3COOCH2CH2CH3.A是由B与乙酸、丙醇发生酯化反应后生成的产物,A结构简式为: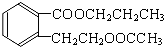 .
.
(1)由上述分析可知,E的分子式为C5H10O2,故答案为:C5H10O2;
(2)B中含有羧基、羟基,在一定条件下可以发生缩聚反应生成某高分子化合物,此高分子化合物的结构简式为 ,故答案为:
,故答案为: ;
;
(3)D(CH3CH2CH2OH)也可以由溴代烃F在NaOH溶液中加热来制取,此反应的化学方程式为:CH3CH2CH2Br+NaOH$→_{△}^{水}$CH3CH2CH2OH+NaBr,
故答案为:CH3CH2CH2Br+NaOH$→_{△}^{水}$CH3CH2CH2OH+NaBr;
(4)反应①的化学方程式为: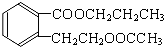 +2 NaOH$\stackrel{△}{→}$
+2 NaOH$\stackrel{△}{→}$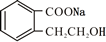 +CH3COONa+CH3CH2CH2OH,
+CH3COONa+CH3CH2CH2OH,
故答案为: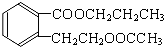 +2 NaOH$\stackrel{△}{→}$
+2 NaOH$\stackrel{△}{→}$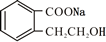 +CH3COONa+CH3CH2CH2OH;
+CH3COONa+CH3CH2CH2OH;
(5)B有多种同分异构体,同时符合下列四个条件的结构简式:a.能够发生水解,含有酯基,b.能发生银镜反应,含有醛基,c.能够与FeCl3溶液显紫色,含有酚羟基,d.苯环上的一氯代物只有一种,符合条件的同分异构体有: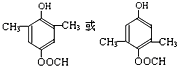 ,
,
故答案为: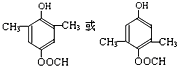 .
.
点评 本题考查有机物的推断,关键是计算确定E的结构简式,结合反应条件与转化关系,采用正推或逆推的方式进行推断,需要学生熟练掌握官能团性质与转化,难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:实验题
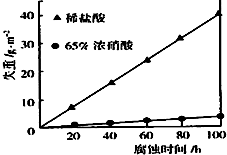 按要求回答下列问题:
按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往某溶液中加入稀NaOH溶液,无刺激性气味的气体产生,说明该溶液一定不含NH4+ | |
| B. | 用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl会升华 | |
| C. | SO2气体和Cl2均能使品红溶液褪色,说明两者均有强氧化性 | |
| D. | 浓硫酸可用来干燥H2、Cl2、SO2等气体,说明浓硫酸具有吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO${\;}_{3}^{-}$、NO3- | B. | Na+、SO${\;}_{4}^{2-}$、Cl-、ClO- | ||
| C. | H+、Mg2+、SO${\;}_{4}^{2-}$、NO3- | D. | Ag+、K+、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的组成可以用H3+表示 | B. | 它比普通氢分子多一个氢原子核 | ||
| C. | 它一定含3个中子 | D. | 可以推测它的化学性质与H2不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,11.2L氧气中所含有的原子数为NA | |
| B. | 17g的NH3分子中含有的电子数为10NA | |
| C. | 常温常压下,48g O3含有的氧原子数为3NA | |
| D. | 标准状况下,11.2LH2O中所含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com