
| A. | 向蔗糖溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2检验水解产物 | |
| B. | 用酸性高锰酸钾溶液鉴别乙烷与乙烯 | |
| C. | 用饱和Na2CO3溶液除去乙酸乙酯中的少量乙酸 | |
| D. | 利用燃烧的方法鉴别羊毛和蚕丝 |
分析 A.葡萄糖和新制氢氧化铜悬浊液反应生成砖红色沉淀必须在碱性条件下;
B.乙烯能被酸性高锰酸钾溶液氧化,乙烷不能被酸性高锰酸钾溶液氧化;
C.乙酸乙酯不同于饱和碳酸钠溶液,乙酸可与碳酸钠反应;
D.羊毛和蚕丝的成分是蛋白质,蛋白质灼烧时有烧焦羽毛的气味.
解答 解:A.葡萄糖和新制氢氧化铜悬浊液反应生成砖红色沉淀必须在碱性条件下,所以在滴加新制氢氧化铜悬浊液之前必须滴加NaOH溶液中和未反应的酸,故A错误;
B.乙烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,乙烷不能被酸性高锰酸钾溶液氧化,所以现象不同,可以鉴别,故B正确;
C.乙酸乙酯不同于饱和碳酸钠溶液,乙酸可与碳酸钠反应,可用于除杂,故C正确;
D.羊毛和蚕丝的成分是蛋白质,蛋白质灼烧时有烧焦羽毛的气味,无法鉴别,故D错误;
故选BC.
点评 本题考查化学实验方案评价,为高频考点,涉及物质检验、物质鉴别,明确实验原理及基本操作即可解答,易错选项是A,注意该反应条件必须是碱性条件下.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、Cl-、NO3- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Al3+、Mg2+、SO42-、Na+ | D. | Na+、NH4+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
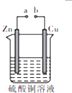
| A. | a和b不连接时,锌片上会有紫红色固体析出 | |
| B. | a和b用导线连接时,铜片上的电极反应是Cu2++2e-→Cu | |
| C. | a和b用导线连接时,溶液的颜色加深 | |
| D. | 无论a和b是否连接,锌片均会溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| B. | 道尔顿、汤姆生、卢瑟福和门捷列夫等对原子结构模型的建立均作出了卓越的贡献 | |
| C. | 化学反应能制造出新的物质,也能制造出新的元素,并伴有能量变化 | |
| D. | 感染MERS致死率较高,为防止感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol的NH3和1mol的NH4+都有10×6.02×1023个质子 | |
| B. | 室温下,NH4NO2溶液呈酸性,则说明Ka(HNO2)<Kb(NH3•H2O) | |
| C. | NH4+(aq)+2O2(g)═NO3-(aq)+2H+(aq)+H2O(l);△H=-346kJ/mol | |
| D. | 在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E是中学化学常见的物质.其中,A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体.其转化关系如下:
A、B、C、D、E是中学化学常见的物质.其中,A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体.其转化关系如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1gH2和8gO2 | |
| B. | 0.1molHCl和2.24LHe | |
| C. | 150℃,1.01×105Pa时,18LH2O和18LCO2 | |
| D. | 常温常压下28gCO和6.02×1022个CO分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com