
| A、反应处于平衡状态时,c(NH3)?c(O2)=c(NO)?c(H2O) |
| B、反应达到平衡后,ν正(NH3)=ν逆(H2O) |
| C、其它条件不变,温度越高,氨的转化率越高 |
| D、寻找合适的催化剂是加快反应速率并提高NO产率的有效措施 |


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol?L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
| C、如果苯酚浓液沾到皮肤上,应立即用酒精洗 |
| D、配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
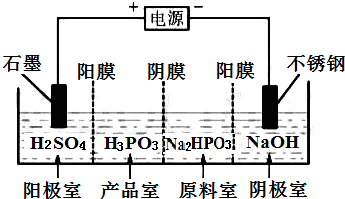 亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3.
亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3.查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
| C、[H+]和[OH-]的乘积 | ||
| D、OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠 | B、铜 | C、铝 | D、铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1s22s22p63s23p2→1s22s22p63s23p1 |
| B、1s22s22p2→1s22s22p1 |
| C、1s22s22p4→1s22s22p3 |
| D、1s22s22p3→1s22s22p2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com