
 向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)  CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
mol CO2+1 mol H2
B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
不饱和酯类化合物在药物、涂料等领域应用广泛.下列反应是一种由烯烃制备不饱和酯的新方法:

(1)化合物I的分子式为 ,1mol化合物I能与 mol H2恰好完全反应生成饱和烃类化合物.
(2)化合物Ⅰ可由芳香族化合物Ⅱ或Ⅲ分别通过消去反应获得,但只有Ⅱ能与Na反应产生H2,Ⅱ的结构简式为 、 ;由Ⅲ生成Ⅰ的反应条件为 .
(3)聚合物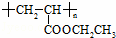 可用于制备涂料,其单体结构简式为 .若仅以乙烯为唯一有机物原料合成该聚合物,写出其中涉及的化学反应方程式
可用于制备涂料,其单体结构简式为 .若仅以乙烯为唯一有机物原料合成该聚合物,写出其中涉及的化学反应方程式
.
查看答案和解析>>
科目:高中化学 来源: 题型:
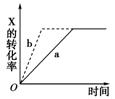
在某一容 积为5 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)
积为5 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g),反应中CO2的浓度随时间变化情况如图:
(1)根据图中数据,反应开始至达到平衡时,CO的化学反应速率为 ________________,反应达平衡时,c(H2)=________。
(2)判断该反应达到平衡的依据是________(填序号)。
①CO减少的 速率和CO2减少的速率
速率和CO2减少的速率 相等
相等
②CO、H2O、CO2、H2的浓度都相等
③CO、H2O、CO2、H2的浓度都不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒温密闭容器中,可逆反应A(s)  B+C(g)-Q达到平衡。缩小容器体积,重新达到
B+C(g)-Q达到平衡。缩小容器体积,重新达到
平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q
查看答案和解析>>
科目:高中化学 来源: 题型:
反应Fe(s)+CO2(g)FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正
确的是 ( )
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K=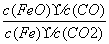
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g) 
 Z(g)+W(g);ΔH>0
Z(g)+W(g);ΔH>0
下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
A.增大压强 B.升高温度 C.增大CO的浓度 D.分离出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室以含有Ca2+、Mg2+、Cl-、SO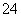 、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
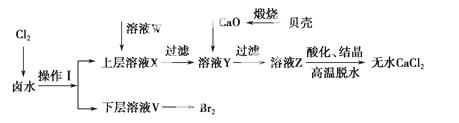
(1)操作Ⅰ使用的试剂是________,所用主要仪器的 名称是________。
名称是________。
(2)加入溶液W的目的是________。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择的pH最大范围是________。酸化溶液Z时,使用的试剂为________。
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1. |
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是________。
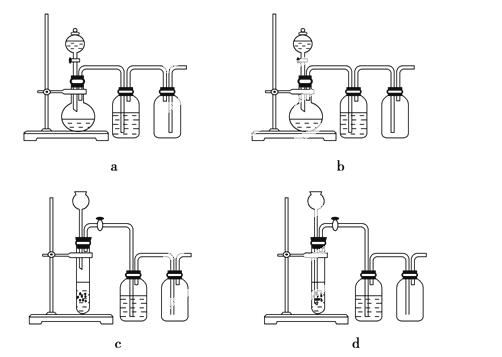
(4)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3酸性强于H2CO3;将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于________。设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论)。
____________________________。仪器自选。供选择的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com