
分析 (1)第一份加入几滴AgNO3溶液后有沉淀产生,溶液中可能含有Cl-、CO32-、SO42-;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,该气体是氨气,一定有铵根离子,铵根离子的物质的量是0.02mol,无沉淀生成,一定不含Fe3+、Mg2+;
(3)在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g,说明原溶液中一定存在Al3+,结合离子共存可知一定不存在CO32-;1.02g为氧化铝的质量,其物质的量为:$\frac{1.02g}{102g/mol}$=0.01mol,说明每份溶液中含有0.02molAl3+;
(4)第三份加足量BaCl2溶液后,得白色沉淀,该白色沉淀为硫酸钡,说明原溶液中一定存在SO42-,则一定不存在钡离子;沉淀经足量盐酸洗涤、干燥后,质量为11.65g,则硫酸钡的物质的量为:$\frac{11.65g}{233g/mol}$=0.05mol,说明每份溶液中含有0.05molSO42-;
0.02molAl3+所带正电荷为0.06mol、0.02mol铵根离子带有0.02mol正电荷,而0.05molSO42-所带负电荷为0.1mol,根据电荷守恒可知,说明溶液中一定还含有阳离子K+,据此对各选项进行判断.
解答 解:第一份加入几滴AgNO3溶液后有沉淀产生,溶液中可能含有Cl-、CO32-、SO42-;
第二份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,该气体是氨气,一定有铵根离子,铵根离子的物质的量是0.02mol,无沉淀生成,一定不含Fe3+、Mg2+;在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g,说明原溶液中一定存在Al3+,结合离子共存可知一定不存在CO32-;1.02g为氧化铝的质量,其物质的量为:$\frac{1.02g}{102g/mol}$=0.01mol,说明每份溶液中含有0.02molAl3+;
第三份加足量BaCl2溶液后,得白色沉淀,该白色沉淀为硫酸钡,说明原溶液中一定存在SO42-,则一定不存在钡离子;沉淀经足量盐酸洗涤、干燥后,质量为11.65g,则硫酸钡的物质的量为:$\frac{11.65g}{233g/mol}$=0.05mol,说明每份溶液中含有0.05molSO42-;
0.02molAl3+所带正电荷为0.06mol、0.02mol铵根离子带有0.02mol正电荷,而0.05molSO42-所带负电荷为0.1mol,根据电荷守恒可知,说明溶液中一定还含有阳离子K+,
(1)根据分析可知,一定存在的离子为:K+、NH4+、Al3+、SO42-,
故答案为:K+、NH4+、Al3+、SO42-;
(2)一定不存在的离子为:Fe3+、Mg2+、CO32-、Ba2+,
故答案为:Fe3+、Mg2+、CO32-、Ba2+;
(3)根据分析可知,无法确定是否存在Cl-,所以溶液中可能存在Cl-,
故答案为:Cl-;
(4)实验(2)中滴加NaOH溶液的过程中,铝离子优先与氢氧根离子反应生成氢氧化铝沉淀,然后铵根离子与氢氧根离子结合生成一水合氨,最后氢氧化铝溶解,按照反应先后顺序所发生反应的离子方程式为:Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=[Al(OH)4]-,
故答案为:Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=[Al(OH)4]-;
(5)溶液中正电荷的总物质的量为:n(NH4+)+3n(Al3+)=0.02mol+3×0.02mol=0.08mol,
负电荷的总物质的量为:2n(SO42-)=0.1mol,根据电荷守恒,溶液中一定存在钾离子,由于可能存在氯离子,则钾离子的物质的量至少为:0.1mol-0.08mol=0.02mol,其浓度c(K+)≥$\frac{0.02mol}{0.1L}$=0.2mol/L;
铝离子的浓度为:c(Al3+)=$\frac{0.02mol}{0.1L}$=0.2mol/L、铵根离子的浓度为:c(NH4+)=$\frac{0.02mol}{0.1L}$=0.2mol/L,
故答案为:c(Al3+)=0.2mol.l-1、c(NH4+)=0.2mol.l-1、c(K+)≥0.2mol.l-1.
点评 本题考查常见离子的检验,题目难度中等,采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息,尤其是K+的确定易出现失误.


科目:高中化学 来源: 题型:解答题
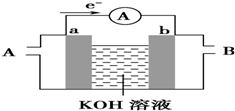 (1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH. 请回答下列问题:
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH. 请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
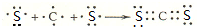 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
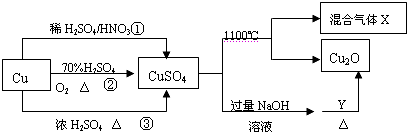
| A. | 1mol CuSO4在1100℃所得混合气体X中O2可能为0.75mol(X的组成为SO2、SO3、O2) | |
| B. | 相对于途径①、②,途径③更好地体现了绿色化学理念 | |
| C. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| D. | Y一定是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p1 | B. | 1s22s22p33s1 | ||
| C. | 1s22s22p63s23p63d104s2 | D. | 1s22s22p63s23p63d34s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ②③ | C. | ①② | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期中同主族元素的最外层电子数及化学性质完全相同 | |
| D. | 同周期元素的原子半径从左到右依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
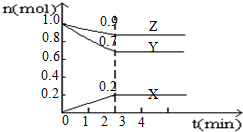 某温度时,在4L的容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在4L的容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com