
【题目】Ⅰ、海水是可以综合利用的。从海水中提取食盐和溴的过程:

(1)请写出一种海水淡化的方法________________________。
(2)步骤Ⅰ获取Br2的离子方程式为_________________________________________________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,还原剂是________(填化学式)。
Ⅱ、海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。证明海带中含有碘的实验步骤:
①用剪刀剪碎海带,用酒精湿润,放入坩埚中。
②灼烧海带至完全成灰,停止加热,冷却。
③将海带灰加蒸馏水溶解,搅拌、煮沸、过滤。
④在滤液中滴加稀硫酸及过氧化氢,然后加入几滴淀粉溶液,(涉及反应的离子方程式为2I-+H2O2+2H+=I2+2H2O)。
能证明海带中含有碘的实验步骤是________(填序号),现象是_________________________。
【答案】蒸馏法 Cl2+2Br-===Br2+2Cl- SO2 ④ 滴入淀粉溶液后变蓝
【解析】
通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-===Br2+2Cl-,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-===Br2+2Cl-,然后采用萃取的方法获取Br2,以此解答该题。
(1)淡化海水的方法有:蒸馏法、电渗析法、离子交换法等;
(2)氯气具有氧化性,能氧化溴离子生成单质溴:Cl2+2Br-===Br2+2Cl-;
(3)化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,因Br2中Br的化合价从0价降低为1价,Br2是氧化剂,S元素化合价升高,SO2为还原剂
Ⅱ、能证明海带中含有碘的实验操作是第④步,碘离子在酸性条件下,被双氧水氧化成碘单质,取少量第④步的溶液,滴加几滴淀粉溶液,观察到的现象是溶液变蓝。


科目:高中化学 来源: 题型:
【题目】(1)用系统命名法命名下列物质
①![]() __________________________
__________________________
②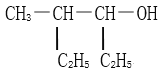 _________________________
_________________________
(2)有机物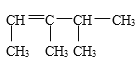 的系统命名是____,将其在催化剂存在的条件下完全氢化,所得烷烃的系统命名是 _______________________________________________。
的系统命名是____,将其在催化剂存在的条件下完全氢化,所得烷烃的系统命名是 _______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
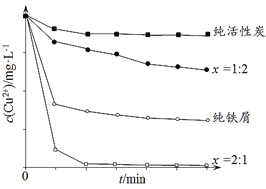
下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3物质的量浓度分别为0.1mol/L和0.3mol/L,则10min内生成SO3的化学反应速率为___________;SO2的转化率为___________。
(2)下列关于该反应的说法正确的是_________。
A.增加O2的浓度能加快反应速率B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中若某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是______。
A.O2为0.2mol/LB.SO2为0.25mol/L
C.SO3为0.4mol/LD.SO2、SO3均为0.15mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1) 氯化炉中Al2O3、Cl2和C反应的化学方程式为____________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为__________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
① 写出上述除杂过程中涉及的离子方程式___________、____________。
② AlCl3产品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨甲环酸(G),别名止血环酸,是一种已被广泛使用半个世纪的止血药,它的一种合成路线如下(部分反应条件和试剂略):

回答下列问题:
(1)A的结构简式是________。
(2)C的化学名称是__________。
(3)②的反应类型是________。
(4)E中不含N原子的官能团名称为_______。
(5)氨甲环酸(G)的分子式为________。
(6)写出满足以下条件的所有E的同分异构体的结构简式:________。a.含苯环 b.含硝基 c.核磁共振氢谱有三组峰
(7)写出以![]() 和
和 为原料,制备医药中间体
为原料,制备医药中间体 的合成路线:__(无机试剂任选)。
的合成路线:__(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种饲料营养强化剂。一种利用水钴矿(主要成分为
是一种饲料营养强化剂。一种利用水钴矿(主要成分为![]() 、
、![]() ,还含少量
,还含少量![]() 、
、![]() 、MnO等),制取
、MnO等),制取![]() 的工艺流程如图1:
的工艺流程如图1:
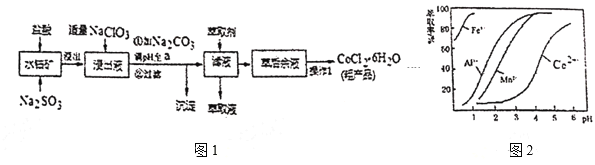
已知:①浸出液含有的阳离子主要有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等;
等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③![]() 熔点为86℃,加热至110~120℃时,失去结晶水生成无水氧化钴。
熔点为86℃,加热至110~120℃时,失去结晶水生成无水氧化钴。
沉淀物 |
|
|
|
|
|
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中![]() 发生反应的离子方程式____。
发生反应的离子方程式____。
(2)写出NaClO3发生反应的主要离子方程式____,若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(3)“加![]() 调pH至a”,过滤所得到的沉淀成分为___。
调pH至a”,过滤所得到的沉淀成分为___。
(4)制得的![]() 在烘干时需减压烘干的源因是___。
在烘干时需减压烘干的源因是___。
(5)萃取剂对金属高子的萃取率与pH的关系如图2。向“滤液”中加入萃取剂的目的是___﹔其使用的最佳pH范围是___。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 17g H2O2中含有非极性键的数目为NA
B. 常温常压下,17g甲基(-14CH3)所含的中子数为9NA
C. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
D. 13. 8g NO2与足量水反应,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.Na2S2O3溶液与稀H2SO4反应:S2O32-+6H+=2S↓+3H2O
B.在海带灰的浸出液中滴加H2O2得到I2:2I+H2O2+2H+=I2+O2↑+2H2O
C.向 NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶2时:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com