
����Ŀ���ϳɰ��������ѧ�����ϵ�һ���ش�ͻ�ƣ��䷴Ӧԭ��ΪN2(g)��3H2(g)![]() 2NH3(g) ��H����92.4 kJ��mol��1��һ�ֹ�ҵ�ϳɰ��ļ�ʽ����ͼ���£�
2NH3(g) ��H����92.4 kJ��mol��1��һ�ֹ�ҵ�ϳɰ��ļ�ʽ����ͼ���£�
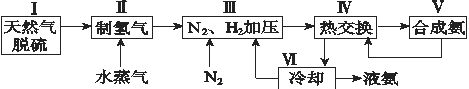
(1)��Ȼ���е�H2S���ʳ��ð�ˮ���գ�����ΪNH4HS��һ����������NH4HS��Һ��ͨ��������õ�������ʹ����Һ������д��������Ӧ�Ļ�ѧ����ʽ��_______________��
(2)���������������ԭ�����£�
��CH4(g)��H2O(g)![]() CO(g)��3H2(g) ��H����206.4 kJ��mol��1
CO(g)��3H2(g) ��H����206.4 kJ��mol��1
��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H����41.2 kJ��mol��1
CO2(g)��H2(g) ��H����41.2 kJ��mol��1
���ڷ�Ӧ�٣�һ���������ƽ����ϵ��H2�İٷֺ��������ܼӿ췴Ӧ���ʵĴ�ʩ�� __��
���÷�Ӧ�ڣ���CO��һ��ת���������H2�IJ�������1 mol CO��H2�Ļ������(CO���������Ϊ20%)��H2O��Ӧ���õ�1.18 mol CO��CO2��H2�Ļ�����壬��CO��ת����Ϊ____________��
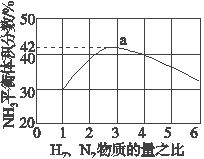
(3)��ͼ��ʾ500 �桢60.0 MPa�����£�ԭ����Ͷ�ϱ���ƽ��ʱNH3��������Ĺ�ϵ������ͼ��a�����ݼ���N2��ƽ�����������______________��
(4)��������ͼ�У�ʹ�ϳɰ��ų��������õ�������õ���Ҫ������(�����)_____________����������������ߺϳɰ�ԭ����ת���ʵķ�����_________________��
���𰸡�
(1)2NH4HS��O2![]() 2NH3��H2O��2S��
2NH3��H2O��2S��
(2)�����¶ȣ�90%��(3)14.5%
(4)������ԭ������ѹ������Һ����δ��Ӧ��N2��H2ѭ��ʹ��
��������
���������(1)H2S���ʳ��ð�ˮ���գ�����ΪNH4HS��һ����������NH4HS��Һ��ͨ��������õ�������ʹ����Һ��������Ӧ����������һˮ�ϰ�������ԭ���غ�͵����غ���ƽ��д��ѧ����ʽΪ��2NH4HS+O2![]() 2NH3H2O+2S���ʴ�Ϊ��2NH4HS+O2
2NH3H2O+2S���ʴ�Ϊ��2NH4HS+O2![]() 2NH3H2O+2S����
2NH3H2O+2S����
(2)��Ӧ��CH4(g)+H2O(g) ![]() CO2(g)+3H2(g)��H=+206.4 kJmol-1�������������������ȷ�Ӧ��һ���������ƽ����ϵ��H2�ٷֺ�����˵��ƽ��������У����ܼӿ췴Ӧ���ʣ�˵��Ӱ�췴Ӧ���ʵ��������������¡���ѹ������Ũ�ȵȣ�������Ӧ������֪��Ӧ��������ҷ�Ӧ���������ֻ������ƽ�������ȷ�Ӧ���У�ƽ��������з�Ӧ�����������÷�Ӧ�ڣ���CO��һ��ת���������H2��������1mol CO��H2�Ļ������(CO���������Ϊ20%)�� COΪ0.2mol��H2�����ʵ���Ϊ0.8mol����H2O��Ӧ���õ�1.18mol CO��CO2��H2�Ļ�����壬���ݷ�Ӧǰ������������䣬���ӵIJ���Ӧ������ʼ��ˮ���������ʵ���Ϊ0.18mol����ת����һ����̼�����ʵ���Ϊx��
CO2(g)+3H2(g)��H=+206.4 kJmol-1�������������������ȷ�Ӧ��һ���������ƽ����ϵ��H2�ٷֺ�����˵��ƽ��������У����ܼӿ췴Ӧ���ʣ�˵��Ӱ�췴Ӧ���ʵ��������������¡���ѹ������Ũ�ȵȣ�������Ӧ������֪��Ӧ��������ҷ�Ӧ���������ֻ������ƽ�������ȷ�Ӧ���У�ƽ��������з�Ӧ�����������÷�Ӧ�ڣ���CO��һ��ת���������H2��������1mol CO��H2�Ļ������(CO���������Ϊ20%)�� COΪ0.2mol��H2�����ʵ���Ϊ0.8mol����H2O��Ӧ���õ�1.18mol CO��CO2��H2�Ļ�����壬���ݷ�Ӧǰ������������䣬���ӵIJ���Ӧ������ʼ��ˮ���������ʵ���Ϊ0.18mol����ת����һ����̼�����ʵ���Ϊx��
CO(g) + H2O(g) ![]() CO2(g)+H2(g)��H=-41.2 kJmol-1
CO2(g)+H2(g)��H=-41.2 kJmol-1
��ʼ��(mol) 0.2 0.18+x 0 0.8
�仯��(mol) x x x x
ƽ����(mol) 0.2-x 0.18 x x+0.8
��0.2-x+x+x+0.8=1.18��x=0.18����COת����Ϊ![]() ��100%=90%���ʴ�Ϊ�������¶ȣ�90%��
��100%=90%���ʴ�Ϊ�������¶ȣ�90%��
(3)���ݷ�Ӧ����N2+3H2=2NH3 ��V
1 3 2 2
ƽ����� V V
����Ӧǰ�����������СΪ���ɰ������������ͬ�����£���������ȵ����������ʵ���֮�ȣ�ͼ�������֪ƽ��״̬�����������42%����ƽ�����������Ϊ100������Ϊ���42����Ӧǰ�������100+42=142����������������1��3��ϣ��������=142��![]() =35.5�����ݻ�ѧ����ʽ���㷴Ӧ�ĵ������Ϊ21��ƽ��״̬����Ϊ35.5-21=14.5�������������Ϊ14.5%���ʴ�Ϊ��14.5%����
=35.5�����ݻ�ѧ����ʽ���㷴Ӧ�ĵ������Ϊ21��ƽ��״̬����Ϊ35.5-21=14.5�������������Ϊ14.5%���ʴ�Ϊ��14.5%����
(4)�������̺ϳɰ�����ͨ�����Ƚ��������ȷ�Ӧ������壬ʹ��Ӧ�ﵽ�����¶ȣ���ߺϳɰ�ԭ����ת���ʣ�����ƽ���ƶ�ԭ������������������ٽ�ƽ��������У���ƽ���������е�������������ѭ��ʹ�ã����ԭ�������ʣ��ʴ�Ϊ����������Һ����δ��Ӧ�ĵ���������ѭ��ʹ�á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ԭ�Ӿ����У����ۼ��ļ���Խ���۷е�Խ��
B. ���Ӿ����У����Ӽ�������Խ�÷���Խ�ȶ�
C. ����������ֻ���������ӹ��ɾ���
D. ����������۵�һ���ȷ��Ӿ���ĸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1000molL��1NaOH��Һ�ζ�δ֪Ũ�ȵ�HCl��Һ������������ȷ����( )
A����ʽ�ζ�����װ��Һǰδ�ô�װҺ��ϴ2��3�Σ�ʹ�ⶨ���ƫ��
B���ζ��յ�ʱ�����Ӷ�����ʹ�ⶨ���ƫС
C��ֻ��ѡ�÷�̪��ָʾ��
D���������һ��NaOH��Һ����ҺͻȻ��ɫ����Ϊ�ζ��յ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.Li������ý�����F������÷ǽ���
B.ϡ������ԭ�ӵ�������������Ϊ8
C.Ԫ�����ڱ���7�����壬7�����壬1��0�壬1�����壬��16����
D.X2+�ĺ��������ĿΪ10����X�ڵ������ڵڢ�A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.4gNaOH �� 1.06g Na2CO3��ϲ������Һ�� ����Һ�еμ� 0.1mol��L-1ϡ���ᡣ ����ͼ������ȷ��ʾ������������������ CO2�����ʵ����Ĺ�ϵ���ǣ� ��
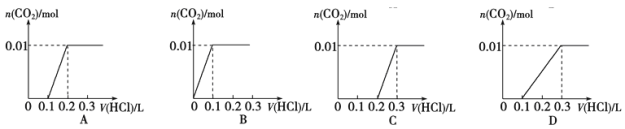
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.���ε�صķŵ��������ڿ��淴Ӧ
B.����������ڿ�����ȼ�ն����ɹ�������
C.�����ڱ��У������������ڸ���Ԫ�ص�����������
D.�����ڱ�����Ԫ����Ѱ�Ҵ��������ʴ�����µĺϽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ����Ҫ�ɷ���K2SO4��Al2(SO4)3��2Al2O3��6H2O������������Fe2O3���ʡ���������ʯ�Ʊ������������������£�
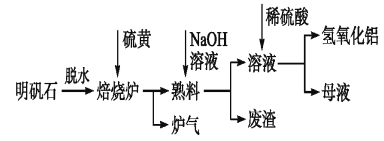
��1������¯�з�����Ӧ�Ļ�ѧ����ʽΪ2Al2(SO4)3+3S![]() 2Al2O3+9SO2���÷�Ӧ����������___________��������1 mol Al2O3����ת�Ƶĵ�����Ϊ__________________��
2Al2O3+9SO2���÷�Ӧ����������___________��������1 mol Al2O3����ת�Ƶĵ�����Ϊ__________________��
��2�������ܽ�ʱ����Ӧ�����ӷ���ʽΪ________________��
��3��ĸҺ��������Ҫ�ɷ�Ϊ__________�����ѧʽ��
��4�������������Ҫ�ɷֵķ�����
������__________________________��
������__________________________��
������__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����к���������̼ԭ�������ǣ� ��
A. CBr2F2 B. CH3CH2CH2OH C. CH3CH2CH3 D. CH3CH(NO2)COOH
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com