
| A. | 金属钠投入水中的离子方程式;Na+2H2O=Na++2OH-+O2↑ | |
| B. | 常温下,0.1mol/L氯化铵溶液pH=5的原因:NH4++H2O?NH3•H2O+H+ | |
| C. | 用惰性电极电解饱和食盐水的阳极反应式:2Cl--2e-=Cl2↑ | |
| D. | 乙醛与新制的氢氧化铜悬浊液反应的离子方程式:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |
分析 A、钠和水之间反应生成氢氧化钠和氢气;
B、氯化铵溶液中的铵根离子可以水解,导致溶液显示酸性;
C、电解池的阳极上发生失电子的氧化反应,根据离子的放电顺序来回答;
D、含有醛基的物质可以和新制的氢氧化铜悬浊液之间反应生成砖红色沉淀.
解答 解:A、钠和水之间反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B、氯化铵溶液中的铵根离子可以水解NH4++H2O?NH3•H2O+H+,导致溶液显示酸性,故B正确;
C、电解池的阳极上发生失电子的氧化反应,电解饱和食盐水的阳极反应式::2Cl--2e-=Cl2↑,故C正确;
D、含有醛基的物质可以和新制的氢氧化铜悬浊液之间反应生成砖红色沉淀,乙醛与新制的氢氧化铜悬浊液反应的离子方程式:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O,故D正确.
故选A.
点评 本题考查学生物质的性质以及离子方程式的书写知识,注意知识的归纳和梳理是解题的关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.48LCH3CH2OH中约含有1.204×1023个羟基 | |
| B. | 常温常压下,31g白磷P4和红磷P8的混合中约含有6.02×1023个磷原子 | |
| C. | 标准状况下,7.8g苯中约含有1.806×1023个碳碳双键 | |
| D. | 1molH2O2在MnO2催化作用下完全反应转移的电子数约为1.204×1024个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的CH3COOH溶液中:c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的NH4Cl溶液中:c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入15mol H2和0.5mol N2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应时失去的电子数为0.1NA | |
| C. | 0.1L的0.1mol•L-1 Na2S溶液中含有的S2-离子数为0.1NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
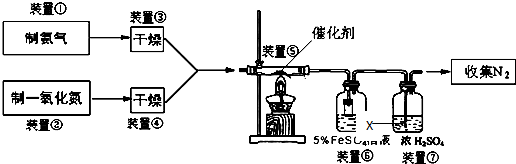

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )| A. | X与Y只形成一种化合物 | |
| B. | 单质Z溶于热的NaOH,生成Na2SO3和另一种盐,若转移电子数为2NA,则参加反应单质Z的质量为64g | |
| C. | XW3与H2O发生非氧化还原反应,只生成两种物质,其中一种为XH3,则另一种物质为HWO | |
| D. | ZY2气体通入BaCI2溶液中有白色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com