
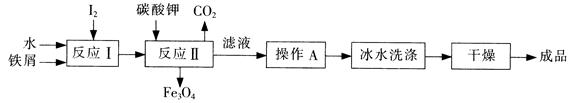
 =3:8,故反应方程式是Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑。
=3:8,故反应方程式是Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑。

科目:高中化学 来源:不详 题型:填空题
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42 | 2560 | Br- | 64 |
| Mg2+ | 1272 | | |


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.35.5:108 | B.16:207 | C.8:1 | D.108:35.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1︰2︰3 | B.3︰2︰1 | C.6︰3︰1 | D.6︰3︰2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
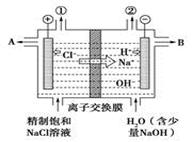
| A.转移电子0.8 mol时产生氢气8.96 L |
| B.从出口B处导出的是氢氧化钠与氯化钠的混合溶液 |
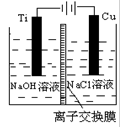
| C.装置中出口①处的气体能使湿润的淀粉碘化钾试纸变蓝 |
| D.装置中的阳离子交换膜防止产生的氯气与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
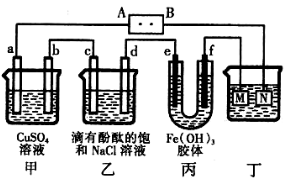
| A.电源B端是正极 |
| B.a、c电极均有单质生成,其物质的量之比为2:1 |
| C.欲用丁装置给铜镀银,N应为Ag,电解液为AgNO3溶液 |
| D.f极附近变红,说明氢氧化铁胶粒带正电荷 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
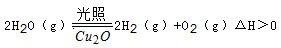
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
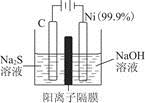
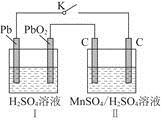
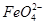 。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
。实验过程中,两极均有气体产生,Y极区溶液逐渐生成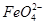
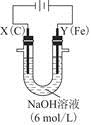
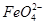 +4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
+4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com