
| A. | 胶体的聚沉是化学变化 | |
| B. | 含有0.01mol FeCl3的溶液制成的胶体中,胶体粒子的数目约为6.02×1021个 | |
| C. | 胶体的介稳性与胶体粒子直径大小有关 | |
| D. | NaCl晶体既可制成溶液又可制成胶体 |
科目:高中化学 来源: 题型:选择题
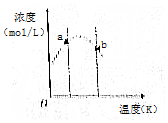 对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )
对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )| A. | 该反应的正反应是吸热反应 | B. | a处反应速率比b处反应速率大 | ||
| C. | 反应方程式中计量数x=1 | D. | b状态时:v(正)=v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
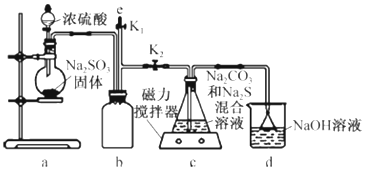
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
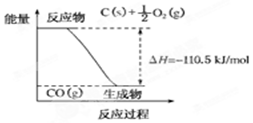
| A. | 12g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ | |
| B. | 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ | |
| C. | 该反应的热化学方程式是2C(s)+O2(g)═2CO(g);△H=-221 kJ | |
| D. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(4s)>E(3d) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 用标准盐酸滴定未知浓度的烧碱,滴定前仰视,滴定后俯视,烧碱浓度偏低 | |
| C. | pH均为11的NaOH和NH3•H2O溶液中,水的电离程度不相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-1/2(4x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com