
如图a、b、c、d均为石墨电极,通电进行电解,b极有64 g Cu析出。
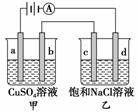
下列说法不正确的是( )
A.甲中a电极反应式为4OH--4e-===O2↑+2H2O
B.电解时向乙中滴入酚酞溶液,d电极附近变红
C.向乙中通入2 mol HCl气体,溶液组成可以恢复
D.c电极产生2 g气体
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
下列区分物质的方法不正确的是( )。
A.用燃烧的方法可以区分甲烷和乙烯
B.用酸性KMnO4溶液区分苯和CCl4
C.用新制Cu(OH)2悬浊液区分蔗糖和葡萄糖
D.用KI溶液区分淀粉溶液和鸡蛋白溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
设C+CO2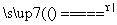 2CO,正反应是吸热反应,反应速率为v1。N2+3H2
2CO,正反应是吸热反应,反应速率为v1。N2+3H2
 2NH3,正反应是放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
2NH3,正反应是放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在合成氨时,要使氨的产率增大,又要使化学反应速率增大,可以采取的措施有( )
①增大体积使压强减小 ②减小体积使压强增大 ③升高温度 ④降低温度 ⑤恒温恒容,再充入等量的N2和H2
⑥恒温恒压,再充入等量的N2和H2 ⑦及时分离产生的NH3 ⑧使用正催化剂
A.②④⑤⑦ B.②③④⑤⑦⑧ C.②⑤ D.②③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。达到平衡时平衡混合物中NH3的含量(体积分数)[入料V(N2)∶V(H2)=1∶3]
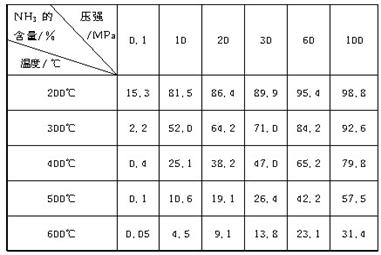
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向____________方向移动,正反应方向为________(填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨适宜的条件是________。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(3)计算500℃,30 MPa时N2的转化率________。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施:________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,A为直流电源,B为浸透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为________极。
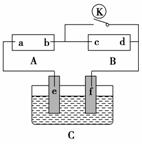
(2)滤纸B上发生的总化学反应方程式为__________________________________________________________
__________________________________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为__________________________,电极f上发生的反应为________________________,槽中盛放的电镀液可以是________或________(只要求填两种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用所作的判断,其中正确的是( )
①SiO2+2NaOH===Na2SiO3+H2O
②SiO2+2C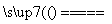 Si+2CO↑
Si+2CO↑
③SiO2+4HF===SiF4↑+2H2O
④Na2CO3+SiO2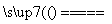 Na2SiO3+CO2↑
Na2SiO3+CO2↑
⑤SiO2+3C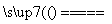 SiC+2CO↑
SiC+2CO↑
a.反应①中SiO2作为玻璃的主要成分被消耗,用于雕刻玻璃
b.反应②中SiO2表现为氧化性
c.反应③中SiO2表现了酸性氧化物的通性
d.反应④中SiO2将挥发性的酸酐从其盐中置换出来
e.反应⑤中SiO2未参加氧化还原反应
A.ace B.bde
C.cde D.dab
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,甲、乙两烧杯均盛有5 mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述正确的是(双选)( )
A.溶液的体积10V甲≤V乙
B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH :甲≤乙
查看答案和解析>>
科目:高中化学 来源: 题型:
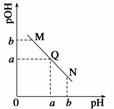
某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )
A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com