
| A. | ②③④⑤ | B. | ③④⑤⑦ | C. | ④⑤⑥ | D. | ④⑤⑦ |
分析 既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的有机物,应含有不饱和碳碳键或醛基,以此解答该题.
解答 解:①甲烷为饱和烃,与酸性高锰酸钾或溴水都不反应,故①错误;
②苯结构特殊、性质稳定,与酸性高锰酸钾或溴水都不反应,故②错误;
③聚乙烯不含不饱和键,不能与酸性高锰酸钾或溴水反应,故③错误;
④聚乙炔含有碳碳双键,可与酸性高锰酸钾或溴水反应,故④正确;
⑤2-丁炔含有碳碳三键,可与酸性高锰酸钾或溴水反应,故⑤正确;
⑥环己烷不含不饱和键,不能与酸性高锰酸钾或溴水反应,故⑥错误;
⑦环己烯含有碳碳双键,可与酸性高锰酸钾或溴水反应,故⑦正确.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,题目难度不大,注意常见有机物官能团的性质,把握与酸性高锰酸钾或溴水反应的物质.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:解答题
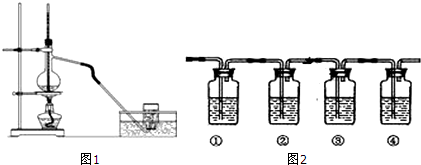
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| B. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 某吸热反应能自发进行,因此该反应是熵增反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | 金属钠和水的反应:Na+2H2O=H2↑+Na++2OH- | |
| C. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+=Al3++3H2O | |
| D. | Ba(OH)2溶液中加入稀H2SO4:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
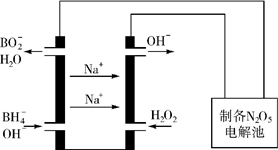 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)| 0.01mol•L-1溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18个质子,19中子,19电子 | B. | 18个质子,20个中子,18个电子 | ||
| C. | 19个质子,18个中子,20个电子 | D. | 18个质子,19个中子,18个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑦ | B. | ②④⑥ | C. | ②④⑤⑥⑦ | D. | ②⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com