
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使红色石蕊试纸变蓝色的溶液中: K+、CO32- 、NO3- 、AlO2-
B.滴人酚酞溶液显红色的溶液中: K+、Na+、Cu2+、SO42-
C.由水电离产生的(H+) = 10-13mol/L的溶液中:Na+、Cl-、NO3-、CH3COO-
D.pH = l 的溶液中: Na+、Fe2+、NO3-、Cl-
科目:高中化学 来源:2017届内蒙古高三上9月月考化学卷(解析版) 题型:选择题
甲、乙两烧瓶中各盛有100mL 3mol·L-1的盐酸和氢氧化钾溶液,向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为( )
A.2.7g B.3.6g C.5.04g D.4.05g
D.4.05g
查看答案和解析>>
科目:高中化学 来源:2017届江苏省无锡市三校联合体高三上第一次月考化学试卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)  2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C.保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)=0.24 mol
D.该温度下此反应的平衡常数:K=1.44
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:填空题
锌是一种常用金属,镓(Ga)的化合物氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
⑴Ga的原子结构示意图为 ___________________。
⑵GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式 。
⑶下列有关镓和镓的化合物的说法正确的是____ 。
A.常温下,Ga可与水剧烈反应放出氢气
B.一定条件下,Ga可溶于盐酸和氢氧化钠
C.一定条件下,Ga2O3可与NaOH反应生成盐
D.Ga2O3可由Ga(OH)3受热分解得到
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
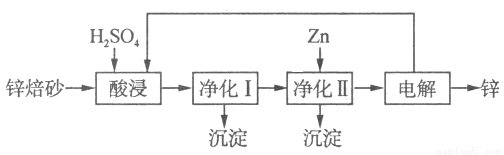
已知:Fe的活泼性强于Ni
⑷ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为 。
⑸净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________。
⑹净化II中加入Zn的目的是___________________。
⑺常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________。已知:Ksp[Fe(OH)3] = 8.0 × 10-38;lg5 = 0.7
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
A~E是中学常见的5种化合物,A、B是氧化物 ,它们之间的转化关系如图所示。
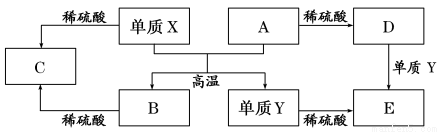
则下列说法正确的是( )
A.单质Y在一定条件下能与水发生置换反应
B.向D溶液中滴加KSCN溶液,产生血红色沉淀
C.X与A反应的化学方程式是 Al2O3+2Fe Fe2O3+2Al
Fe2O3+2Al
D.由于氧化物A和B均能与酸反应所以均是碱性氧化物
查看答案和解析>>
科目:高中化学 来源:2017届四川省校高三上学期第二次月考化学试卷(解析版) 题型:填空题
【化学-选修3:物质结构与性质】
A、B、C、D、E五种元素的原子序数依次增大。A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍;D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态。试回答下列问题:
(1)基态D原子核外电子的排布式为___________________。
(2)B、C、D三种元素的电负性由大到小的顺序是_______________________(填元素符号)。
(3)E(NH3)2+ 4离子的颜色是___________;含有化学键类型是_________________;离子中N原子杂化轨道类型是_________________。
(4)D、E能形成两种晶体,其晶胞分别如甲、乙两图。晶体乙中,E的配位数为_________;在一定条件下,甲和C2A4反应生成乙,同时生成在常温下分别为气体和液体的另外两种常见无污染物质。该化学反应方程式为___________________________。

(5)若甲的密度为ρ g/cm3,NA表示阿伏加德罗常数,则甲晶胞的边长可表示为_________cm。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:实验题
已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO + 2Cu(OH)2 + NaOH  CH3COONa + Cu2O↓+ 3H2O
CH3COONa + Cu2O↓+ 3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL[ | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 m L
L
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知 :Cu2O在碱性条件下稳定
:Cu2O在碱性条件下稳定 ,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实 验步骤是 。
验步骤是 。
基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:选择题
下列与化学反应能量变化相关的说法不正确的是
A.任何化学反应都伴随着热量的变化
B.一个反应是吸热反应还是放热反应要看反应物和生成物具有总能量的相对大小
C.化学键的断裂一定吸收能量, 化学键的形成一定释放能量
D.化学反应过程的能量变化除热能外,也可以是光能、电能等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com