
分析 (1)t℃时,将 2molSO2 和 1molO2 通入体积为 2L 的恒温恒容密闭容器中,2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 1 0
变化量(mol):0.4 0.2 0.4
平衡量(mol):1.6 0.8 0.4
根据v=$\frac{△c}{△t}$计算v(SO3),平衡时SO2转化率=$\frac{消耗二氧化硫物质的量}{二氧化硫起始物质的量}$×100%;
(2)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(3)升高温度、使用正催化剂、增大反应物浓度均可以增大反应速率,扩大容器的体积,压强减小,反应速率减慢,恒容条件下通入氦气,反应混合物浓度不变,反应速率不变;
(4)设n(SO2)=n(O2)=1mol,转化的二氧化硫为xmol,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):1 1 0
变化量(mol):x 0.5x x
平衡量(mol):1-x 1-0.5x x
再根据混合气体体积减少了 20%列方程计算解答.
解答 解:(1)t℃时,将 2molSO2 和 1molO2 通入体积为 2L 的恒温恒容密闭容器中,2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 1 0
变化量(mol):0.4 0.2 0.4
平衡量(mol):1.6 0.8 0.4
v(SO3)=$\frac{\frac{0.4mol}{2L}}{2min}$=0.1mol/(L.min),平衡时SO2转化率=$\frac{0.4mol}{2mol}$×100%=20%,
故答案为:0.1mol/(L.min);20%;
(2)A.随反应进行,容器内气体物质的量进行,容器内压强减小,容器内压强不再发生变化说明到达平衡,故A正确;
B.SO2 的体积分数不再发生变化说明到达平衡,故B正确
C.容器内气体原子总数始终不变,故C错误;
D.相同时间内消耗 2nmolSO2 的同时消耗 nmolO2,均表示正反应速率,反应始终按该比例关系进行,故D错误;
E.相同时间内消耗 2nmolSO2的同时生成 nmolO2,而消耗 2nmolSO2的同时消耗 nmolO2,氧气的生成与消耗相等,说明到达平衡,故E正确;
F.混合气体总质量不变,容器容积不变,混合气体密度始终不变,故F错误,
故选:ABE;
(3)A.向容器中通入O2,氧气浓度增大,反应速率加快,故A正确;
B.扩大容器的体积,压强减小,反应速率减慢,故B错误;
C.使用正催化剂,反应速率加快,故C正确;
D.升高温度,反应速率加快,故D正确;
E.恒容条件下通入氦气,反应混合物浓度不变,反应速率不变,故E错误,
故选:ACD;
(4)设n(SO2)=n(O2)=1mol,转化的二氧化硫为xmol,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):1 1 0
变化量(mol):x 0.5x x
平衡量(mol):1-x 1-0.5x x
混合气体体积减少了 20%,则2×20%=2-(1-x+1-0.5x+x),解得x=0.8,平衡时SO2转化率=$\frac{0.8mol}{1mol}$×100%=80%,
故答案为:80%.
点评 本题考查化学平衡计算、平衡状态判断、反应速率计算与影响因素,难度不大,注意对基础知识的理解掌握.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
卤素互化物(XX’n)的性质与卤素单质相似,其中非金属性: X<X’。已知反应如下:3H2O + 2ICl3 = 5HCl + ICl + HIO3。则下列判断正确的是:( )
A.XX’n 属于活泼非金属单质
B.ICl3 属于共价化合物
C.上述反应中HCl是还原产物
D.ICl溶于水的反应:ICl + H2 O = HIO + HCl 不属于氧化还原反应
O = HIO + HCl 不属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
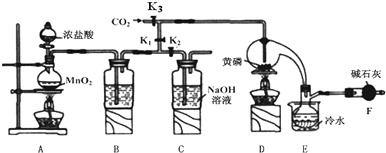
 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它易溶于水,不溶于醇,受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它易溶于水,不溶于醇,受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45mol | B. | 0.8mol | C. | 0.9mol | D. | 1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的路线如图所示.请按要求作答
的路线如图所示.请按要求作答
 .
. ,F
,F .
. ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 18mol/L浓硫酸与足量铜加热充分反应,其中有0.09NA个H2SO4体现了氧化性 | |
| B. | 33.6LCl2一定能与56g铁在加热条件下发生反应 | |
| C. | 12.0g熔融的NaHSO4中含有的阳离子数为0.2NA | |
| D. | 在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有21NA个电子发生转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com