
| A. | Na2CO3 | B. | NaHCO3 | ||
| C. | Na2CO3和NaHCO3 | D. | NaOH、Na2CO3和NaHCO3 |
分析 二氧化碳和氢氧化钠反应方程式有CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,n(CO2)=$\frac{16.8L}{22.4L/mol}$=0.75mol,n(NaOH)=1mol/L×1.00L=1mol,如果生成NaHCO3,根据化学式知,0.75molCO2完全反应消耗NaOH0.75mol<1mol,如果生成Na2CO3,0.75molCO2完全反应消耗NaOH1.5mol>1mol,实际上0.75mol<n(NaOH)<1.5mol,据此判断溶液中溶质.
解答 解:二氧化碳和氢氧化钠反应方程式有CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,n(CO2)=$\frac{16.8L}{22.4L/mol}$=0.75mol,n(NaOH)=1mol/L×1.00L=1mol,如果生成NaHCO3,根据化学式知,0.75molCO2完全反应消耗NaOH0.75mol<1mol,如果生成Na2CO3,0.75molCO2完全反应消耗NaOH1.5mol>1mol,实际上0.75mol<n(NaOH)<1.5mol,则溶液中溶质为Na2CO3和NaHCO3,故选C.
点评 本题考查化学方程式有关计算,为高频考点,注意:反应物物质的量都已知时要进行过量计算,采用极限法分析判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
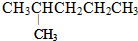 的是( )
的是( )| A. | CH3CH=CHCHCH2CH3 | B. | CH2=CHCHCH2CH3 | ||
| C. | CH≡CCHCH2CH3 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温度、同体积的N2和O2 | B. | 同压强、同体积的H2和CH4 | ||
| C. | 同质量、不同密度的N2和CO | D. | 同体积、同密度的CO2和N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 金属钠跟水反应:2Na+2H2O=2Na++2OH-+H2↑ | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ | |
| D. | 用醋酸除水垢(主要成分为碳酸钙):2H++CO32-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质.他们采用了以下操作制备胶体,请将空白处填写完整.
某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质.他们采用了以下操作制备胶体,请将空白处填写完整.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com