
 磷元素是生命体中重要的元素之一
磷元素是生命体中重要的元素之一分析 (1)磷是某种核素中,中子数比质子数多一,所以中子数为16,所以质量数为31;
(2)N与P处在同一主族,根据碘化氨合碱的反应书写反应方程式;
(3)该方程式中Cu价态由+2→+1,所以氧化剂是硫酸铜,还原剂是PH3;24molH2SO4转移电子为24mol;
(4)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐分别是硫酸氢钾和硫酸氢铵,且物质的量之比为1:1:1,根据原子守恒分析解答;
(5)①氧硫化碳(COS)中硫三个电子层,其它两个是两个电子层,所以硫原子半径最大;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,依据电荷守恒和原子守恒书写离子反应方程式;
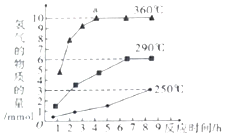
③根据图示反应时间与H2产量的关系,a点时M溶液中除S2O32-外,还有SO42-.
解答 解:(1)磷是某种核素中,中子数比质子数多一,所以中子数为16,所以质量数为31,所以该核素的原子符号为3115P,故答案为:3115P;
(2)铵盐和碱反应生成氨气,N与P处在同一主族,磷盐和碱反应生成磷化氢,反应为:PH4I+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+NaI+H2O,
故答案为:PH4I+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+NaI+H2O;
(3)该方程式中Cu价态由+2→+1,所以氧化剂是硫酸铜,还原剂是PH3,24molH2SO4转移电子为24mol,所以196克H2SO4时,转移电子的物质的量为2mol,故答案为:PH3;2;
(4)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐分别是硫酸氢钾和硫酸氢铵,且物质的量之比为1:1:1,反应方程式为:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑,
故答案为:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑;
(5)①氧硫化碳(COS)中硫三个电子层,其它两个是两个电子层,所以硫原子半径最大,硫在周期表中的位置为第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,
故答案为:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-;
③反应Ⅲ中,a点360℃时,随着时间推移,氢气的量不变,Na2S初始含量为3mmol,若只发生:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,生成氢气:3mmol×2=6mmol,图中为9mmol,说明M溶液中除S2O32-外,还有SO42-,离子反应为S2-+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$SO42-+4H2↑,
故答案为:SO42-.
点评 本题考查学生氧化还原反应的方程式的书写以及电子转移的计算知识,属于综合知识的考查,侧重分析与应用能力的考查,注意含硫物质的性质及规律性知识的应用,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 取4g 漂粉精固体,加入100mL 水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
 | 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
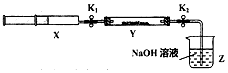
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | (1)淡黄色固体变为白色粉末 | (2)反应的化学方程式:SO2+Na2O2=Na2SO4 |
| 将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | (3)Z中NaOH溶液倒吸入Y管中 | (4)不用解释 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有0.2mol K2SO4 | |
| B. | K+的物质的量浓度为0.2mol•L-1 | |
| C. | K的物质的量为0.8mol | |
| D. | 取出1LK2SO4溶液后,剩余K2SO4溶液的浓度变为0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室用大理石和盐酸制备二氧化碳 | |
| B. | 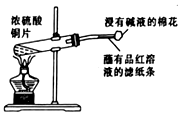 制取SO2、检验SO2的漂白性 | |
| C. | 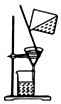 提纯氢氧化铁胶体 | |
| D. | 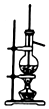 实验室用乙醇和浓硫酸制乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4→MnO2 | B. | HCl→Cl2 | C. | Fe2O3→Fe | D. | CaO→CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+ )=c(OH- )+c(A- ) | |
| B. | 25℃时,pH=4.7浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 氢硫酸的酸性比碳酸弱,则NaHS溶液中:c(Na+)>c(HS-)>c(H+)>c(OH-) | |
| D. | ①0.2mol•L-1NH4Cl溶液②0.1mol•L-1(NH4)2Fe(SO4)2溶液③0.2mol•L-1NH4HSO4溶液④0.1mol•L-1(NH4)2CO3溶液中,c(NH4+ )大小:③>②>①>④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com