
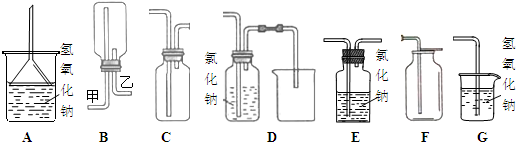
| ||
| ||
| m |
| M |
| 14.9g |
| 74.5g/mol |


科目:高中化学 来源:不详 题型:单选题
| A.某物质灼烧时,焰色反应为黄色,该物质一定是钠的化合物 |
| B.用酒精萃取碘水中的碘 |
| C.称量NaOH固体时,将NaOH固体放在托盘天平左盘的纸上 |
| D.蒸馏时,应将温度计水银球靠近蒸馏烧瓶的支管口附近 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.参加反应的酸和碱的物质的量相等 |
| B.滴定时,应时刻注视滴定管中液面的变化 |
| C.pH=7时,参加反应的酸中的H+总量和碱中OH-总量相等 |
| D.酸和碱恰好完全反应时,反应的热效应即为中和热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
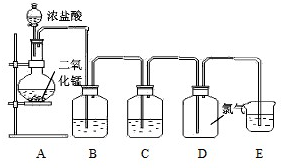
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等于0.15mol | B.大于0.15mol |
| C.小于0.15mol | D.以上结论都不对 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
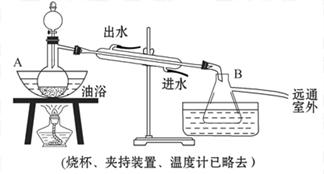
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com