
| A. | NH4+、Cl-、Fe3+、K+ | B. | Na+、SO32-、K+、Cl- | ||
| C. | MnO4-、Fe2+、Na+、SO42- | D. | K+、SO42-、HCO3-、Na+ |
科目:高中化学 来源: 题型:解答题
| a | b | ||
| x | y | z |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
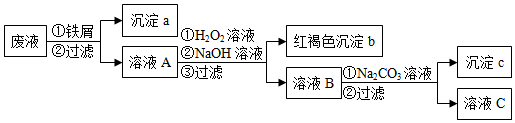
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
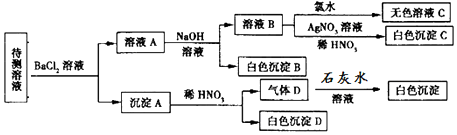
| A. | SO42-、SO32-至少含有一种 | |
| B. | 沉淀B的化学式为BaCO3 | |
| C. | 肯定存在的阴离子有CO32-、HCO3-、Cl- | |
| D. | 肯定没有的离子是Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
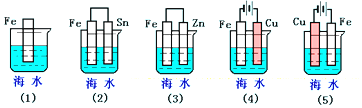
| A. | (5)(2)(1)(3)(4) | B. | (2)(5)(3)(4)(1) | C. | (5)(3)(4)(1)(2) | D. | (1)(5)(3)(4)(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶于水能导电,属于电解质 | |
| B. | 使品红溶液褪色,有漂白性 | |
| C. | 使酸性高锰酸钾溶液褪色,有还原性 | |
| D. | 能杀菌、消毒,可按照国家标准用作食物的防腐剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com