
 .
. 分析 ①氧化剂化合价降低;
②根据反应2KMnO4+16HCl=2MnCl2↑+2KCl+5C12↑+8H2O,KMnO4中Mn化合价由+7降低到+2,则KMnO4为氧化剂,生成MnCl2为还原产物,
16HCl中有10HCl的Cl化合价由-1升高到0价,转移电子数为10mol来标电子转移情况.
解答 解:①反应2KMnO4+16HCl=2MnCl2↑+2KCl+5C12↑+8H2O,KMnO4中Mn化合价由+7降低到+2,则KMnO4为氧化剂,故答案为:KMnO4;
②反应2KMnO4+16HCl=2MnCl2↑+2KCl+5C12↑+8H2O,KMnO4中Mn化合价由+7降低到+2,则KMnO4为氧化剂,16HCl中有10HCl的Cl化合价由-1升高到0价,则转移电子数为10mol,所以双线桥表示为: ,
,
故答案为: .
.
点评 本题考查学生氧化还原反应中的基本概念和电子转移知识,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱HX>HY>HZ | B. | 有两种盐能发生水解 | ||
| C. | 分别稀释上述三种溶液,pH均变小 | D. | 三种溶液中离子总数不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15g甲基(-CH3)所含有的电子数是9NA | |
| B. | 7.8g 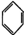 中含有的碳碳双键数为0.3NA 中含有的碳碳双键数为0.3NA | |
| C. | 1mol C2H5OH和1mol CH3CO18OH反应生成水的中子数为8NA | |
| D. | 标准状况下,11.2L己烷所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上物质能导电的是④⑥⑩ | |
| B. | 以上物质属于电解质的是①②③④⑧⑨⑩ | |
| C. | 属于非电解质的是②⑤⑦ | |
| D. | 以上物质中,溶于水能够导电的物质是①②④⑤⑦⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的电离方程式:H2SO4=H2++SO42- | |
| B. | CO2的电子式: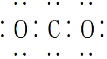 | |
| C. | Cl-离子的结构示意图: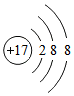 | |
| D. | 苯的结构简式:C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KI和NaBr | B. | KCl和NaCl | C. | KCl和NaBr | D. | KCl、NaCl和I2 |
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
已知有如下反应:①2BrO3-+Cl2=Br2+2ClO3-
②5Cl2+I2+6H2O=2HIO3+10HCl
③ClO3-+5Cl-+6H+=3Cl2↑+3H2O,下列各微粒氧化能力强弱顺序正确的是
A.ClO3->BrO3- >IO3->Cl2 B.BrO3->Cl2>ClO3->IO3-
C.Cl2>BrO3->ClO3->IO3- D.BrO3->ClO3->Cl2>IO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com